一种具有催化作用的碳自由基的新发现和它在有机合成上的应用
- 2012-04-11
- 专题
1. 前言
碳自由基有较高的化学反应活性,它是烷基自由基的典型例证。近年来,生成碳自由基的各种方法被积极研究,并广泛应用于有机合成方面。生成烷基自由基的典型方法是通过自由基引发剂例如AIBN存在下,引发烷基卤化物与Bu3SnH或 (Me3Si)3SiH反应;巴顿酯类或酰基过氧化物的热解;或者金属离子的单电子氧化反应1)。然而,这些反应都是化学计量反应,适用于小规模的实验室使用,但很难应用于大规模的工业合成。工业上有一些产生烷基自由基的方法,例如在自由基引发剂下或光致辐照下引发烷烃的反应,这些方法被用于链烷烃的自氧化。然而,自氧化反应过程需要严格的反应条件,尤其应在高温下完成。在如此高的温度下,链烷烃不但发生C-H键的均裂,而且有C-C键的均裂,其中C-C键能比C-H键能低。因此,这类反应的选择性低并且反应效率不足2)。至今,还没有令人满意的常规方法能在温和条件下,使得链烷烃中C-H键均裂而生成有选择性的碳自由基。为了实现这一目标,需要一种新方法能在温和条件下产生碳自由基。这一方法将成为有机合成中一种不可缺少的工具。
最近,我们发现由N-羟基邻苯二甲酰亚胺生成的苯邻二甲酰亚胺N-氧基(PINO)自由基能够在温和的条件下取代多种碳氢化合物(如:烷烃,醇,醚,缩醛和醛)C-H键上的氢原子而生成相应的碳自由基,这些自由基都具有高的选择性和较高的催化效率3)。NHPI被命名为“产生碳自由基的催化剂”(简写成CRPC)。利用CRPC能够合成含氧化合物,例如由烷烃来合成相应酮和羧酸。CRPC同时还有力地促进了官能团在温和条件下加成到烷烃分子上生成具有高选择性的硝基烷烃,烷基磺酸及氧化烷烃,其中这些反应在以前均难以实现。同样也使合成二元羧酸变为可能,例如己二酸常由硝酸氧化而制得,如今利用分子氧经一步反应氧化环己烷就能生成高产率的己二酸。N2O是温室气体中的一种化合物,它所产生的温室效应是CO2的300倍乃至更高,而采用硝酸氧化的方法不可避免的产生温室气体N2O。从绿色化学的角度来讲寻找一种制造己二酸且不产生N2O副产物新的合成方法尤为重要。用CRPC催化烷烃反应生成烷基自由基是一种创新方法并将对化工行业产生重大影响。一些用CRPC催化的反应已经实现了工业化。
2. 催化碳自由基产生方法的新发现
Grochowski和他同事在1977年首次报道了NHPI催化应用,催化乙醚加成到偶氮二羧酸二乙酯(DEAD)上的反应4)。当时并未详尽的描述此反应,也未用实验证明PINO的生成。然而,由于自由基清除剂的存在以至于该反应没有任何进展,公认的反应过程如(合成方案 1)所示。NHPI上羟基酰亚胺基团上的氢原子转加到DEAD上,尔后跟生成的产物N-氧基邻苯二甲酰亚胺和新自由基形成平衡。这一步生成的PINO使α碳上的氢原子分离到醚氧上,产生新的自由基A,A加到DEAD上生成一个新的加成自由基B,自由基B取代醚上的氢原子生成加和物C和自由基A。
另外,Masui等人在1983年报道NHPI作为电解氧化二级醇生成酮的中间产物5)。大家认为在阳极上产生的PINO使醇α碳上的氢原子分离,进而催化其氧化产物生成酮(合成方案 2)。
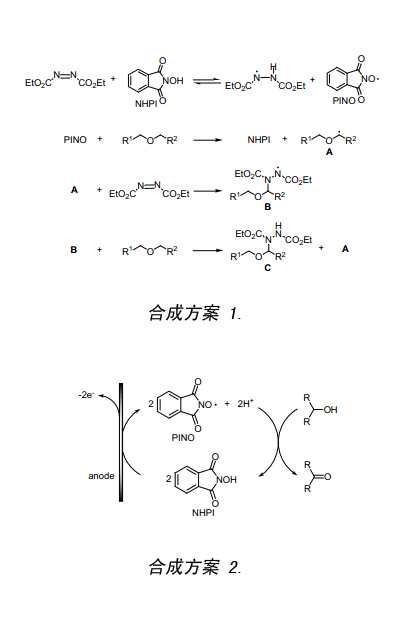
在研究用钼钒磷酸盐(NPMoV)催化醇和分子氧氧化反应过程中,可以形成一个平均成分表示为(NH4)5H6PV8Mo4O40,我们认为单独采用NPMoV催化剂不能引发此反应,但是其如果能与NHPI结合将会增强此反应(合成方案 3)。发现反应过程跟预期设想的一样(路径 a),同时还意外地发现在没有NPMoV存在的情况下NHPI催化醇发生氧化反应过程(路径 b)。该氧化反应是由分子氧(一种三重自由基分子)和NHPI发生反应而致并产生PINO,而后PINO取代醇上的氢原子生成相应的酮。为了证实NHPI产生PINO,在苯甲腈体系中将NHPI与氧分子接触,采用ESR波谱仪观测到PINO生成的一个三重态图谱如图一所示((Figure 1)。
人们发现PINO具有跟CRPC一样的功能,能够在温和的条件下选择性取代有机基质C-H键上的氢原子生成碳自由基,其本身恢复为NHPI。因碳自由基是活性化学物质,所以采用不同种类的分子(例如氧分子)捕获它能够引入不同的官能团。下文详尽叙述了NHPI所催化的多种催化反应,还包括在传统有机合成中未曾出现的新的概念等,因此,NHPI催化也将是化学合成的重大突破。
3. 分子氧氧化烷烃
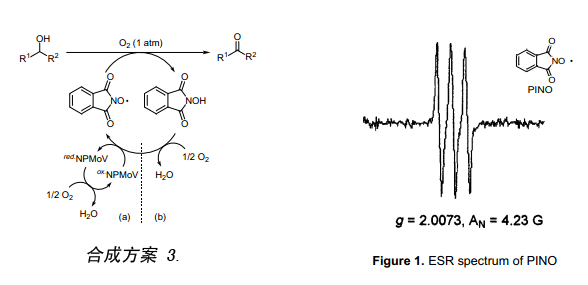
目前,采用环己烷自氧化法来合成尼龙-66每年至少需要2,000,000吨己二酸原料。如今还广泛采用如下两个步骤反应:Co盐存在下,经空气氧化环己烷首先转化成环己酮/环己醇(K/A油),然后再用硝酸K/A油来合成己二酸6a)。本合成方法在1940年由杜邦公司开发,原则上一直延续到今天还在使用。反应第一步需要C-H键断裂(C-H键裂解能:99.5 kcal mol-1),C-H键必须在剧烈的反应条件下(高压,150~170℃)才能断裂。为了避免产生副反应,环己烷的转发率必须控制在3%~5%,从而使得该反应效率不尽如人意。反应第二步采用硝酸氧化产生大量副产物N2O。因为N2O是一种促进全球变暖的物质,所以工业上急需寻求一种不用硝酸氧化就能合成己二酸的新方法。沿着这些思路发展,已经有报道关于采用过氧化氢作氧化剂氧化环己烷生成己二酸,该合成方案作为绿色合成路线引起众多人的关注6b)。
我们发现用NHPI与少量的Mn络合物催化O2(1大气压)氧化环己烷生成己二酸(Eq.1)7),但仅仅采用NHPI却很难使该氧化反应进行。然而, 加入少量的Mn络合物(0.5mol%)后生成己二酸具有很高的选择性,转化率达到70%左右。近年来,不使用任何溶剂就能成功地将环己烷氧化8)。由于NHPI很难溶解于非极性溶剂(例如环己烷)中,因此在没有溶剂的情况下很难有效地催化空气氧化环己烷。结果表明,制备一种亲脂性的NHPI衍生物并拿它作催化剂,在没有溶剂的条件下就能高效地催化空气氧化环己烷((Figure 2)。
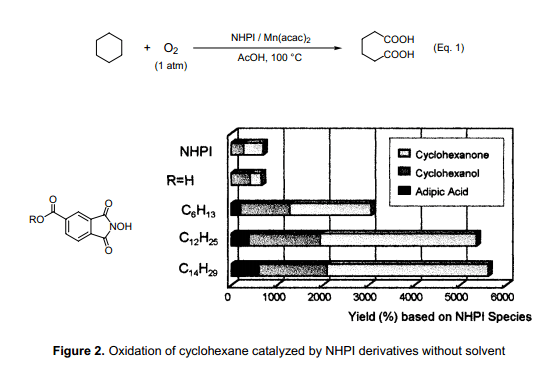
金刚烷具有一种独特的结构,而功能化的金刚烷又是生产高性能材料的重要原料。尽管已有很多化学家尝试用氧分子来氧化金刚烷,但尚无一人获得足够的收率及具有现实目的的选择性。在NHPI/Co催化剂体系、醋酸存在下,分子氧在75℃氧化金刚烷生成产率为85%金刚醇和少量的金刚酮(合成方案 4)9)。就反应条件选择上允许反应生成高选择性的单醇或二元醇。经此合成方法由二醇或三醇合成的丙烯酸和甲基丙烯酸树脂又是合成光刻胶的重要原料。
叔丁醇常用作增加汽油辛烷值的一种添加剂以及高纯度的有机溶剂,工业上采用异丁烯水合的方法制备叔丁醇。异丁烷氧化直接来合成异丁醇是一个更为合理的方法,而采用传统的自氧化过程就是为了合成过氧化叔丁醇,传统合成方法在高压(10大气压),200℃左右的高温下才能产生过氧化叔丁醇(产率大约75%),叔丁醇(产率21%左右)以及8%转化率的丙酮(约2%)10)。在苯甲腈体系中高压条件下用NHPI催化剂催化氧化异丁烷生成产率为80%的叔丁醇(Eq. 2)11)。
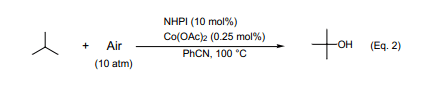
4. 烷基苯的氧化
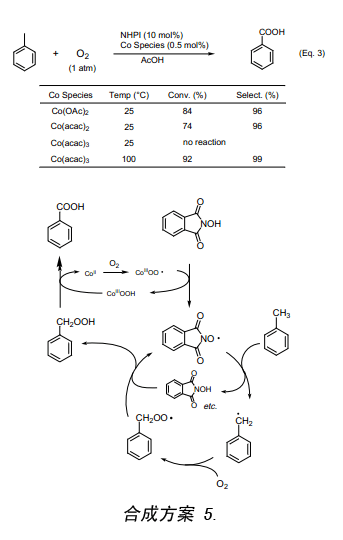
分子氧氧化烷基苯合成羧酸是工业上一种重要的有机合成反应。Co催化剂在高压下130到160℃催化氧化甲苯生成相应的苯甲酸,其转化率为50%,苯甲酸的选择性大约为80%12)。然而采用NHPI和少量的Co(OAc)2作催化剂在1大气压室温条件下就能催化分子氧氧化甲苯生成较高产率的苯甲酸(产率81%)和微量不纯的苯甲醛(Eq. 3)13)。在这些反应条件下,用Co(Ⅲ)替代Co(Ⅱ)后却不能引发该反应,实验证明Co(Ⅱ)盐和氧气反应生成的Co(Ⅲ)氧络合物才能引发此反应(合成方案 5);而用Co(Ⅲ)却不能产生引发反应所必须的Co(Ⅲ)氧络合物,因此在室温下本反应并不发生。当温度升高后Co(Ⅲ)被底物还原成Co(Ⅱ)继而生成的Co(Ⅱ)与氧分子反应形成Co(Ⅲ)氧络合物来引发该反应。因此,使用Co(Ⅲ)时可以观察到反应诱导期。事实证明在常温常压下用分子氧催化氧化烃类如甲苯等对于氧化化学来说有着重要的意义。
对苯二甲酸是合成PET树脂的原料因而其生产量很大,并且在不久的将来其需求量还会增加。如今,用Co/Mn/Br作催化剂在高温高压下经对二甲苯的自氧化来合成对苯二甲酸,此合成方法是由英国阿莫科石油公司开发研制的,其缺点是往气相体系排放溴,腐蚀反应设备,因此人们急切希望研制一种无卤素催化体系的催化剂。
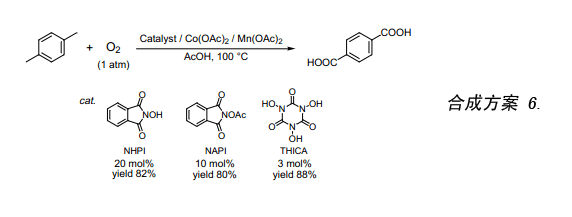
我们采用NHPI催化剂开发了一种无卤素催化氧化反应,该反应用分子氧来氧化对二甲苯生成对苯二甲酸(合成方案 6)。再者,往NHPI上增加一个乙酰基生成N-乙酰基邻苯二甲酰亚胺(NAPI)具有与NHPI相似的高催化活性。实验发现如果我们采用NAPI作催化剂来催化生成相同量的对苯二甲酸所需的催化剂量是NHPI催化剂量的二分之一14)。此外,我们最近还发现三羟基亚氨基氰尿酸(THICA)具有很高的催化活性。NHPI催化氧化对二甲苯经一步反应合成产率为80%的对苯二甲酸需要NHPI催化剂20mol%,而采用THICA催化剂3mol%催化氧化就能得到同样的效果。
氧化烷基杂环化合物所合成的羧酸被广泛用作制药药物合成中间体,例如氧化甲基吡啶合成的烟酸是合成维生素的重要原料。目前,硝酸在高温高压下氧化5-乙基-2-甲基吡啶生成烟酸,可是,关键问题是同时还产生了大量的氮氧化物。与此同时还有报道用Co/Mn/Br催化剂催化甲基吡啶自氧化法合成烟酸,不过其反应条件比较苛刻且选择性非常低15)。
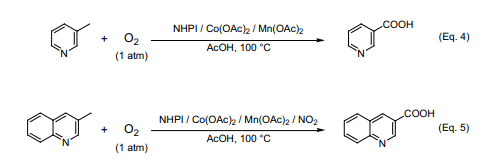
在催化量的NHPI和衡量的Co(OAc)2和Mn(OAc)2存在条件下醋酸环境里,我们用常压的氧气进行β-甲基吡啶氧化实验,结果获得较高产率的烟酸,而且产率可以达到77%(Eq. 4)16a)。NHPI/Co/Mn催化剂催化反应是一个不产生氮氧化物的无污染反应过程,可能在工业合成上非常有用。另外,3-甲基喹啉的氧化产物3-喹啉羧酸在自然界广泛存在,已有很多关于其药理活性的相关报道。但是,在过去很多重金属盐如KMnO4、CrO3常被用作氧化剂,发现往NHPI/Co/Mn催化剂体系中加入少量的NO2催化氧化分子氧跟3-甲基喹啉反应生成较高产率的喹啉羧酸(产率75%)(Eq. 5)16b)。还发现即便不存在过渡金属盐仍然可以采用NHPI/NO2催化分子氧氧化喹啉。尚未发现采用分子氧氧化喹啉的例子,本反应是迄今为止唯一一个成功的用分子氧氧化喹啉的氧化反应。
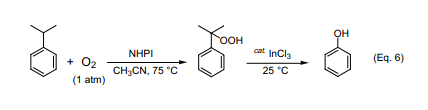
工业合成苯酚采用两步法合成,合成步骤如下:在压缩空气(5到7个大气压)下90到120℃异丙苯在弱碱性体系里自氧化成异丙苯过氧化氢(产率20~30%),然后把未反应的异丙苯从反应溶液中分离、浓缩,再用稀硫酸处理浓缩产物生成苯酚和丙酮。尽管此方法早在20世纪40年代就已经确立应用了,但其至今仍是工业合成苯酚的主要方法。但是,该反应第一步的效率比较低。如果能提高异丙苯转化成异丙苯过氧化氢的产率,该反应还会有更大的用处。发现在没有重金属盐的乙腈体系里向反应溶液中加入少量的氯化铟,在NHPI催化剂跟自由基引发剂AIBN共同作用下可以获得产率为77%的苯酚(Eq. 6)17)。
5. 分子氧氧化烯烃和炔烃
5.1 过氧化氢的合成及烯烃的环氧化反应
烯烃的环氧化反应尤其是采用分子氧作氧化剂氧化丙烯已具有一定的工业规模。最常用的方法是Halcon法(间接氧化法),该合成方法有两个步骤:第一步是乙苯自氧化生成乙苯过氧化物,第二步在Mo催化剂催化下乙苯过氧化物作为环氧化反应的氧化剂完成烯烃的环氧化反应。
在此之前,我们发现NHPI催化剂催化分子氧氧化仲醇生成过氧化氢和酮19),反应中生成的过氧化氢用于烯烃的环氧化反应。在催化量的NHPI和六氟丙酮存在下1-苯乙醇和顺-2-辛烯在常压下氧化气氛反应,再由生成的过氧化氢加成到六氟丙酮上而生成相应的氢过氧化物,随后氢过氧化物做真正的氧化剂反应生成产率为87%的顺-环氧化物(Eq. 7)20)。经自由基中间体生成的醛进展作用于分子氧氧化顺-烯烃发生环氧化反应生成相应的顺或反-环氧化物混合物21)。因而,分子氧氧化顺-烯烃的立体选择性环氧化反应在现实中比较困难。
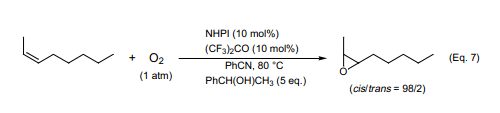
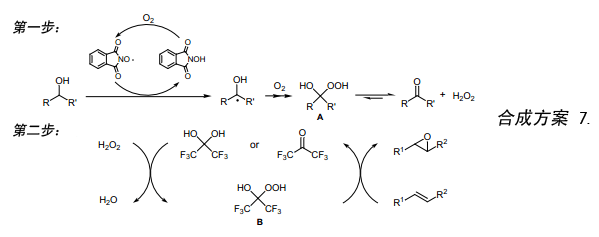
环氧化反应包含两个过程:(i)NHPI催化醇和氧气反应经过中间物α-羟基氢过氧化物(A)生成过氧化氢,这步反应是自由基反应;(ii)由过氧化氢与六氟丙酮反应生成的α-羟基氢过氧化物(B)来氧化烯烃进行环氧化反应(合成方案 7)。NHPI催化剂催化氧化仲醇也可以被用来作为一个极好的合成方法用于合成过氧化氢22)。
5.2 向炔烃的炔丙基位引入氧
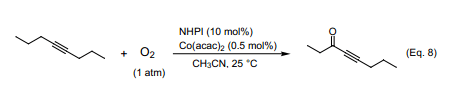
炔烃中炔丙基位上C-H键的离解能大约是85 kcal mol-1,大致等于烯烃中烯丙基位上C-H键离解能量(~87 kcal mol-1 )23)。因此,可以预期的是如果采用NHPI催化剂催化O2来氧化炔烃,炔丙基位可以被选择性氧化,生成相应的α-炔基酮。正如我们所知的在含有NHPI(10mol%)催化剂和微量的Co络合物乙腈体系中,4-辛炔跟O2分子在室温下就能反应生成4-辛炔-3酮,并且产率可达75%(Eq.8)24)。炔酮通常是由一种金属乙炔化物跟酰化试剂发生偶联反应合成制得。将氧引入到炔丙基位置的文献报道非常少,有一个例子是在SeO2催化下叔丁基过氧醇的氧化反应25)。本论文所报道的反应首次成功的把氧气分子中的氧引入反应。
6. 氧气分子氧化K/A油
K/A油是由环己酮和环己醇组成的混合物,是石油工业化学中一种重要的中间体还是用于生产己二酸的原料。拜尔—维立格氧化反应可以把环酮类化合物转化成内酯类化合物。至今,未有关于采用氧气分子作氧化剂的催化拜尔—维立格氧化反应的文献报道,ε-己内酯是由环己酮与过氧乙酸经拜尔—维立格氧化合成而来。假如ε-己内酯的合成不是采用过氧乙酸实现的,而是利用氧气分子作氧化剂K/A油经催化拜尔—维立格氧化反应合成的,那么,此反应由于其可以避免使用有害的过氧乙酸而变得尤为重要。
我们已经提出NHPI作为二级醇有氧氧化的一种高效催化剂。NHPI催化氧化二级醇通过形成羟基过氧化物中间体而产生酮和过氧化氢19)。至此,我们利用存在于K/A油中氧气分子氧化二级醇生成过氧化氢,所生成的过氧化氢用作拜尔—维立格反应的氧化剂。该反应产生的ε-己内酯经有氧氧化反应首先将K/A油体系中的环己醇转化成过氧化氢和环己酮。然后由过氧化氢和InCl3(合成方案 8)26)催化环己酮发生拜尔—维立格氧化反应。三氯化铟是路易斯酸其在水中比较稳定,如果反应后恢复还可以重复使用。
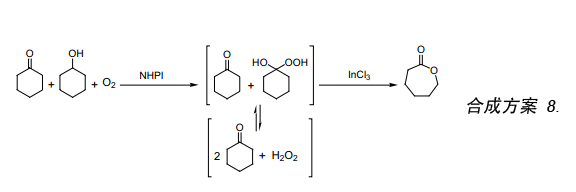
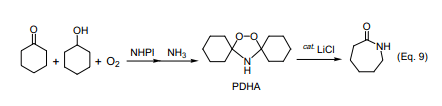
在催化量NHPI存在下,在乙酸乙酯中K/A油先经选择性较好的有氧氧化反应,随后经过氨气处理生成过氧二环己基胺(Eq. 9)。众所周知,PDHA很容易转化成高收率的ε-己内酰胺。此反应是利用氧气分子合成ε-己内酰胺前驱体的一种新方法,由于它不产生反应副产物硫酸铵而显得更加有趣。
7. 使用NHPI催化剂将官能团加到烷烃分子上
7.1 CO引入到金刚烷上
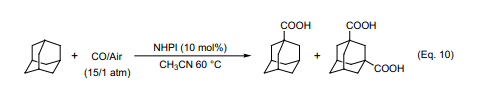
在CO/O2环境中采用NHPI作催化剂金刚烷经彻底的羧化且具有相对较高的选择性。在60℃,NHPI(10%)和CO/Air(15/1大气压)存在条件下金刚烷反应生成金刚羧酸和少量的具有56%选择性的氧化产物(转化率为75%)(Eq. 10)27)。饱和烃经由CO的羰基化反应很难。因此,迄今为止,几乎没有关于烷烃催化自由基羰化反应的文献报道。可以在文献中发现一些采用过硫酸和光引发反应的报道28)。
7.2 烷烃的催化硝化和磺化氧化
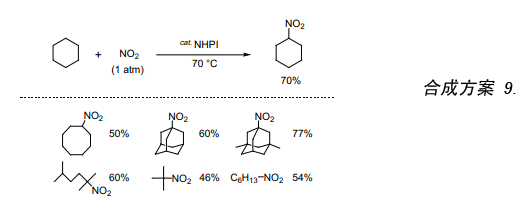
芳香族化合物的硝化和磺化氧化反应是已经确认的反应。但是,至今对于硝化和磺化氧化反应尚未有一个较好的通用型方法。在工业上烷烃的硝化是一个重要的反应,采用硝酸或NO2作硝化剂在温度高达250~400℃方可反应。不过,在这么高的温度下,C-C键的断裂也容易发生,因此,致使硝化反应的选择性相当差。例如,环己烷在240℃与NO2发生硝化反应生成硝基环己烷,其产率仅有16%29)。在催化量的NHPI和O2存在条件下,我们将环己烷跟NO2反应,发现在70℃时就能平稳地反应而且硝基环己烷的产率可以达到70%((合成方案 9)。再者,在反应后经过简单的过滤该催化剂可一定量的收集30)。我们还成功的实现了用硝酸代替NO2作硝化剂进行这类硝化反应31)。
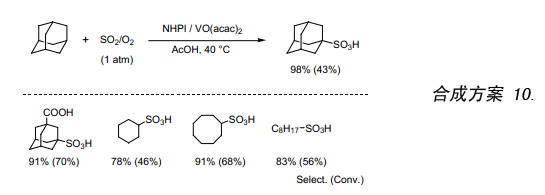
只有少数报道关于烷烃磺化氧化反应的研究。其中一个例子是在SO2/O2存在下烷烃经光引发而反应。但是,该反应的效率很低以至于没有后续的研究报道。我们发现金刚烷跟极少量的VO(acac)2,在SO2/O2环境中用NHPI催化剂催化反应生成产率较高的金刚烷磺酸(合成方案 10)。此外,我们还发现该反应仅由VO(acac)2催化。更进一步说,低碳数烷烃如丙烷在室温下就能用此方法有效的被磺化氧化32)。
7.3 烷烃的肟化反应
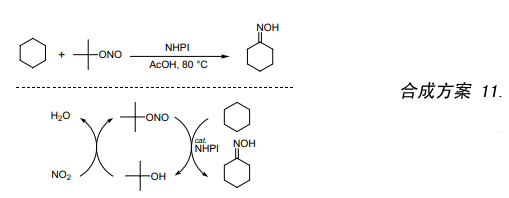
环己酮肟是生产尼龙-6的主要原料之一,其制备方法是先将环己烷氧化成环己酮,然后再与羟胺盐反应。然而,该方法因其反应过程中产生大量的副产物硫酸铵而有很多缺陷。我们发现在氩气作保护气条件下,环己烷与亚硝酸叔丁酯、醋酸在80℃经一步反应生成环己酮肟(合成方案 11)。该反应是合成肟的新方法优点是不产生副产物硫酸铵。此外,一步反应合成环己酮肟已是可能的,并有望成为一种具有突破性的合成方法。再者由于叔丁醇跟NO2很容易反应合成亚硝酸叔丁酯,以及叔丁醇在反应后能够再生并被多次重复使用,此反应具有很高的原子效率。
7.4 NHPI催化剂催化烷烃生成烷基阳离子
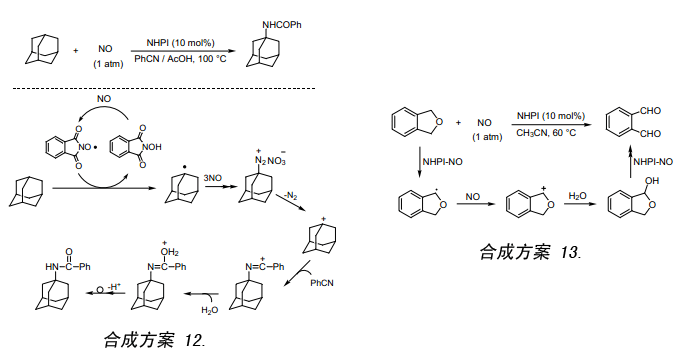
NO是双原子分子常以自由基的形式存在。如果能从NHPI上脱去氢原子生成PINO,那么也同样可以脱去氧分子,这样它可以作为一种新的NO合成反应而应用。我们尝试用NHPI作催化剂,金刚烷跟NO及含有少量醋酸的苄睛反应获得产率为65%的N-1-金刚烷苯甲酰胺(合成方案12)33a)。此外,我们还发现1,3-二氢化异苯并呋喃跟乙腈中的NO反应生成邻苯二甲醛(合成方案13)33b)。邻苯二甲醛还可以通过源于邻二甲苯的四溴邻二甲苯水解得到34)。大家都知道至今还没有直接从1,3-二氢化异苯并呋喃合成邻苯二甲醛的例子。在此反应中,生成的碳正离子作为中间体与亲核试剂水反应生成半缩醛,半缩醛再经相似的反应过程被氧化成邻苯二甲醛。
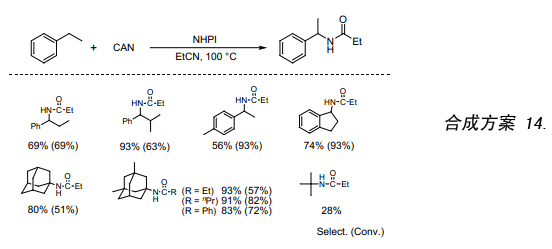
我们发现用NHPI催化剂催化,与硝酸铈铵复盐(CAN)反应产生的烷基自由基再经单电子氧化可以生成烷基阳离子((合成方案 14)。很明显此反应过程中的PINO是由NHPI和CAN反应而生成。在这些条件下,过去在苯甲基位置上发生里特反应比较困难,如今采用本合成方法里特反应变得尤为简单35)。
7.5 NHPI作为极性逆转催化剂
在氩气气氛下,催化量的NHPI ,甲苯作溶剂,BPO引发醛跟烯烃反应生成高产率的相应酮。如(合成方案15)显示的该反应过程类似自由基反应,NHPI做极性逆转催化剂36)。通过将酰基自由基加成到烯烃上生成一个加成自由基,而加成自由基具有亲核性以至于其取代NHPI上的H原子比取代醛上的容易,从而使链反应更加平稳的进行。
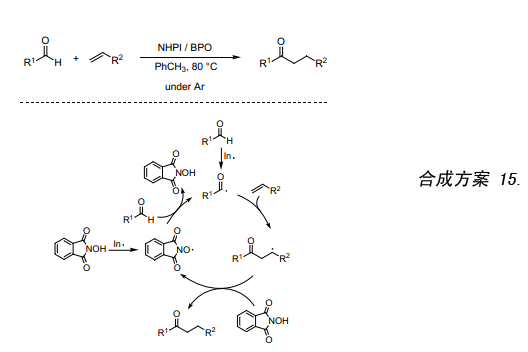
8. 基于生成催化碳自由基的C-C键形成反应
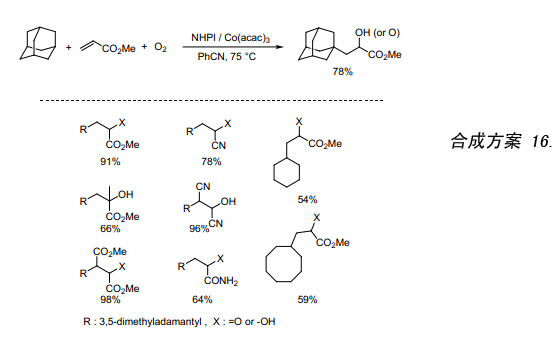
在有机合成中自由基偶合反应是形成C-C键的非常有用的方法。我们已发现有可能采用NHPI/O2体系催化烷烃生成相应的烷基自由基。因此,我们利用烯烃来捕获产生的自由基,我们测试了NHPI/O2催化烷烃与α,β-不饱和酯的反应。在空气气氛下,NHPI/Co(acac)3作催化剂催化金刚烷跟丙烯酸甲酯反应。发现获得了高产率带有分子氧的三元耦合产物,随后金刚烷基自由基加成到丙烯酸甲酯的双键上(合成方案 16)37)。本反应被认为是烷烃的烷氧基化反应且一种新的自由基偶合反应,反应中氧原子的引入与C-C键的形成同时进行。
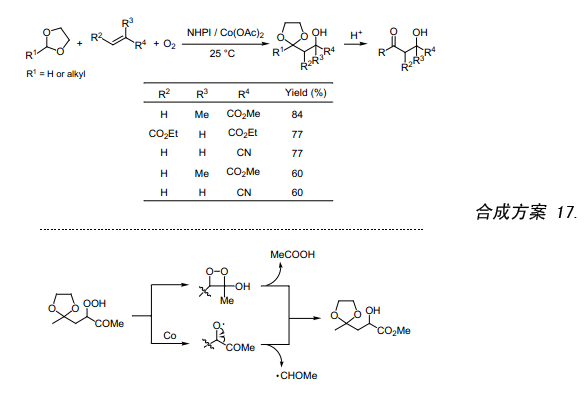
NHPI/O2催化1,3—二氧戊环与丙烯酸甲酯反应,该反应在室温下就能顺利的进行并生成相应的β-羟基缩醛(合成方案 17)。耦合产物上的缩醛经酸处理后很容易转变成相应的酮。此反应是与烯烃加成类似的酰基自由基加成反应,也对烯烃氧化烷基化反应至关重要38)。
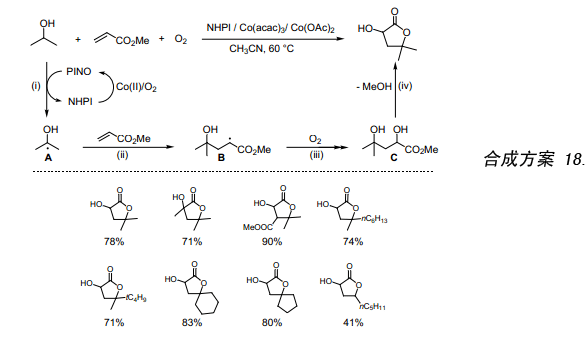
如上所示,NHPI/O2还可以催化醇生成α-羟基碳自由基。因此,尝试用α,β-不饱和酯捕获所生成的α-羟基碳自由基并发现能够合成α-羟基-γ-内酯,在过去α-羟基-γ-内酯用其他合成方法很难得到。在催化量的NHPI和Co盐存在条件下,异丙醇与丙烯酸甲酯反应生成α-羟基-γ,γ-二甲基-γ-丁内酯(合成方案 18)。在本反应中,(i)经NHPI/Co(Ⅱ)催化在氧存在情况下,醇上的氢原子被取代生成α-羟基碳自由基(A),(ii)A加成到丙烯酸甲酯上生成B,(iii)然后把氧原子引入生成二醇C,(iv)C发生分子内环化作用生成内酯。
参考文献
1. (a) Curran, D. P. Comprehensive Organic Synthesis; Trost, B.; Fleming, I. M., Eds.; Pergamon, 1991; Vol. 4, Chapters 4.1 and 4.2 (b) Ryu, I.; Sonoda, N.; Curran, D. P. Chem. Rev. 1996, 96, 172. (c) Renaud, P.; Sibi, M. P. Radicals in Organic Synthesis; Wiley-VCH, 2001; Vol. 1, Basic principles, and Vol. 2, Applications.
2. (a) Sheldon, R. A.; Kochi, J. K. Metal-Catalyzed Oxidations of Organic Compounds; Academic Press, 1981. (b) Hill, C. L. Activation and Functionalization of Alkanes; Academic Press, 1989. (c) The Activation of Dioxygen and Homogeneous Catalytic Oxidation; Barton, D. H. R.; Martell, A. E.; Sawyer, D. T., Eds.; Plenum Press, 1993.
3. (a) Ishii, Y.; Sakaguchi, S.; Iwahama, T. Adv. Synth. Catal. 2001, 343, 393. (b) Ishii, Y. Yuki Gosei Kagaku Kyokaishi (J. Synth. Org. Chem. Jpn) 2000, 59, 1. (c) Ishii, Y.; Sakaguchi, S.; Iwahama, T. Yuki Gosei Kagaku Kyokaishi (J. Synth. Org. Chem. Jpn) 1999, 57, 24.
4. Grochowski, E.; Boleslawska, T.; Jurczak, J. Synthesis 1977, 718.
5. Masui, M.; Ueshima, T.; Ozaki, S. Chem. Commun. 1983, 479.
6. (a) Davis, D. D. Ullman’s Encyclopedia of Industrial Chemistry, 5th ed.; Gerhartz, W., Ed.; John Wiley and Sons: New York, 1985; Vol. A1, pp 270-272. (b) Sato, K.; Aoki, M.; Noyori, R. Science 1998, 281, 1646.
7. (a) Ishii, Y.; Iwahama, T.; Sakaguchi, S.; Nakayama, K.; Nishiyama, Y. J. Org. Chem. 1996, 61, 4520. (b) Iwahama, T.; Shoujo, K.; Sakaguchi, S.; Ishii, Y. Org. Process Res. Dev. 1998, 2, 255.
8. Sawatari, N.; Yokota, T.; Sakaguchi, S.; Ishii, Y. J. Org. Chem. 2001, 66, 7889.
9. Ishii, Y.; Kato, S.; Iwahama, T.; Sakaguchi, S. Tetrahedron Lett. 1996, 37, 4993.
10. Winlker, D. E.; Hearne, G. W. Ind. Eng. Chem. 1961, 53, 655.
11. Sakaguchi, S.; Kato, S.; Iwahama, T.; Ishii, Y. Bull. Chem. Soc. Jpn. 1998, 71, 1237.
12. Parshall, G. W.; Ittel, S. D. Homogeous Catalysis, 2nd ed.; John Wiley and Sons: New York, 1992; pp 255-261.
13. Yoshino, Y.; Hayashi, Y.; Iwahama, T.; Sakaguchi, S.; Ishii, Y. J. Org. Chem. 1997, 62, 6810.
14. Tashiro, Y.; Iwahama, T.; Sakaguchi, S.; Ishii, Y. Adv. Synth. Catal. 2001, 343, 220.
15. (a) Davis, D. D. Ullman’s Encyclopedia of Industrial Chemistry, 5th ed.; Gerhartz, W., Ed.; John Wiley and Sons: New York, 1985; Vol. A27, p 587. (b) Mukhopadhyay, S.; Chandalia, S. B. Org. Process Res. Dev. 1999, 3, 455.
16. (a) Shibamoto, A.; Sakaguchi, S.; Ishii, Y. Org. Process Res. Dev. 2000, 4, 505. (b) Sakaguchi, S.; Shibamoto, A.; Ishii, Y. Chem. Commun. 2002, 180.
17. Fukuda, O.; Sakaguchi, S.; Ishii, Y. Adv. Synth. Catal. 2001, 343, 809.
18. Kitabatake, M.; Ishioka, R. Yuki Kasankabutsu: Sono kagaku to kogyoteki riyou (Organic peroxide: chemistry and industrial application); Kagaku Kogyo Sya: Tokyo, 1972.
19. (a) Iwahama, T.; Sakaguchi, S.; Nishiyama, Y.; Ishii, Y. Tetrahedron Lett. 1995, 36, 6923. (b) Iwahama, T.; Yoshino, Y.; Keitoku, T.; Sakaguchi, S.; Ishii, Y. J. Org. Chem. 2000, 65, 6502.
20. Iwahama, T.; Sakaguchi, S.; Ishii, Y. Chem. Commun. 1999, 727.
21. Mukaiyama, T.; Takai, T.; Yamada, T.; Rhode, O. Chem. Lett. 1990, 1661.
22. Iwahama, T.; Sakaguchi, S.; Ishii, Y. Org. Process Res. Dev. 2000, 4, 94.
23. Golden, D. M. Ann. Rev. Phys. Chem. 1982, 33, 493.
24. Sakaguchi, S.; Takase, T.; Iwahama, T.; Ishii, Y. Chem. Commun. 1998, 2037.
25. Chabaud, B.; Sharpless, K. B. J. Org. Chem. 1979, 44, 4202.
26. Fukuda, O.; Iwahama, T.; Sakaguchi, S.; Ishii, Y. Tetrahedron Lett. 2001, 42, 3479.
27. Kato, S.; Iwahama, T.; Sakaguchi, S.; Ishii, Y. J. Org. Chem. 1998, 63, 222.
28. (a) Barton, D. H. R.; Doller, D. Acc. Chem. Res. 1992, 25, 504. (b) Arndtsen, B. A.; Bergman, R. G.; Mobley, T. A.; Peterson, T. H. Acc. Chem. Res. 1995, 28, 154.
29. Markofsky, S. B. Ullmann’s Encyclopedia Industrial Organic Chemicals; Wiley-VCH: Weinheim, 1999; Vol. 6, p 3487.
30. Sakaguchi, S.; Nishiwaki, Y.; Kitamura, T.; Ishii, Y. Angew. Chem. Int. Ed. Engl. 2001, 40, 222.
31. Isozaki, S.; Nishiwaki, Y.; Sakaguchi, S.; Ishii, Y. Chem. Commun. 2001, 1352.
32. Ishii, Y.; Matsunaka, K.; Sakaguchi, S. J. Am. Chem. Soc. 2000, 122, 7390.
33. (a) Sakaguchi, S; Eikawa, M.; Ishii, Y. Tetrahedron Lett. 1997, 38, 7075. (b) Eikawa, M.; Sakaguchi, S.; Ishii, Y. J. Org. Chem. 1999, 64, 4676.
34. Bill, J. C.; Tarbell, D. S. Organic Syntheses, Collect. Vol. IV; Wiley, 1963; p 807.
35. Sakaguchi, S.; Hirabayashi, T.; Ishii, Y. Chem. Commun. 2002, 516.
36. Tsujimoto, S.; Iwahama, T.; Sakaguchi, S.; Ishii, Y. Chem. Commun. 2001, 2352.
37. Hara, T.; Iwahama, T.; Sakaguchi, S.; Ishii, Y. J. Org. Chem. 2001, 66, 6425.
38. Hirano, K.; Iwahama, T.; Sakaguchi, S.; Ishii, Y. Chem. Commun. 2000, 2457.
39. Iwahama, T.; Sakaguchi, S.; Ishii, Y. Chem. Commun. 2000, 613.
注:本文为提供者翻译的,由于知识所限,其中错误在所难免,敬请原谅。如有问题可以查找原文。



 沪公网安备 31010602001115号
沪公网安备 31010602001115号