糖类在生物活性化合物合成中的应用
- 2012-12-24
- 专题
1. 介绍
在大学的实验室里面,根据研究方向人们会给出一个独特的称谓,比如说“金属催化剂专家”、“天然产品专家” 或者是没有名字。我们的实验室可以被称为“糖专家”。
通常,对于化学家们来说糖类相当于于一个“强大”的工程。他们误认为实验室处理糖类必须需要专门的技术。然而,如果了解了糖的属性,就可以用有机化学里面的常用方法。我们的实验室目前从事糖化学-化学工艺两个研究领域。虽然这两个领域看似不同,但是它们共享基础化学原则,并且彼此密切相关。从这个角度出发, 我们申请了以糖类化学为基础的合成化学用以处理各种项目。
在这片文章中,将介绍我们最近的研究,从糖类合成生物活性化合物以及它们在邮寄合成化学和药物化学中的应用。如果读者通过这篇文章有机会更加熟悉了解糖类我们将倍感荣幸。
2. 糖化学
各种生物大分子将生命系统大致分为:蛋白质、脂类、多糖和核酸,它们分别相应的由氨基酸、脂肪酸、单糖和核苷酸构成。糖类的重要性通过两个单糖和含有D-核糖的核苷酸作为他们的单元结构来进行证实。碳水化合物化学从单糖到多糖范围广泛。重要的是我们能从单糖的物理应用和化学特性中了解更多复杂的多糖。例如,糖化学包括单糖立体化学(微观角度) 和宏观角度上物理分析的多糖结构,比如,细胞壁上的肽聚糖。糖类化学因此与生物活性密切相关,并在同一时间延伸到所有合成化学领域。下一节我们将讨论几个重要的方面,糖化学,尤其是使用糖类合成化学。
糖类含有多种官能团,比如,羟基和氨基基团链接在他们的基础骨干上形成手性化合物。由于这种手性特征,糖类可以具有立体化学复杂结构。这样的化合物可以在温和的条件下进行反应所以用于各种化学品中。例如,反应可以在水合条件下或者是完全中性条件下优先发生。这种限制可能似乎阻碍了实验。但是从我们的角度来看,这意味着糖类合成方法真正适用于几乎所有的其他化学品。这些都是严格意义上的“合成”。
如果我们了解了糖类的这些特点,那么我们就能够从中获取更多收益。例如,其廉价且易获得,糖类常用于手性天然化合物的合成。1)糖链以及衍生物作为生物活性化合物的一个很重要的角色就是预期用作治疗药物将受到的关注。研究人员通过基元反应合成糖链或者是具有潜在生物活性的各种化合物参与到真正有用的化学中来。下一节将介绍我们合成唐衍生生物活性化合物的方法,我们将充分的体会到有机合成化学的本质。
3. 光学活性合成方法的发展,多取代环己烷及合成生物活性化合物的应用
例如D-糖类, D-葡萄糖为代表, 价格便宜并且制备容易,有效地利用这些化合物来合成光学活性化合物在有机合成和将来开发治疗药物中是一个不可或缺的任务。我们也别关注了多取代环己烷这个试剂在糖类生物活性化合物的全合成中的作用。
3.1 氯化钯环转换反应合成糖类的发展2)
光学活性多取代环己烯的合成方法已有很多的报道。尤其是自从Ferrier1979年利用汞化合物3)的[Ferrier (II)反应]研发的一个合成糖类的环化反应, 五元和六元环使用糖类转换已被广泛研究。4) 因为生物活性化合物往往天然存在一个具有多个官能团的环结构,这些环的手性中心立体结构的控制在这些化合物的全合成中变得至关重要。达到这一要求,再怎样强调Ferrier (II)反应在具有复杂构想的化合物中的全合成中的重要性也不为过。5)
Ferrier (II)反应通过水溶液中汞化化学计量数据将5-烯桥吡喃糖苷转换为环己酮(图1)。
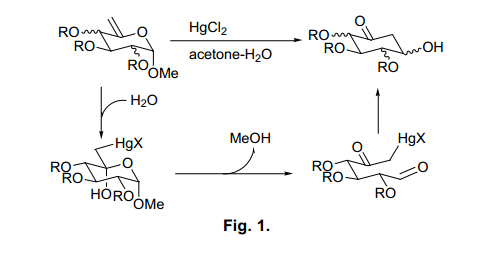
这是一个环的转化反应,从四氢呋喃环岛环己烷的转换,反应步骤开始于烯烃的羟汞化,接着不稳定的半缩醛脱醇与开环反应,二酮分子内羟醛缩合。由于从糖类生物合成肌醇的反应使用类似反应机理,6)这个反应得到越来越多的关注。因此,Ferrier (II)反应在它的反应机理中产生了一个有趣的现象。然而同时在使用汞化反应是有一个严重的问题。尽管汞化催化量最近由Lukacs等7)和Ogawa等8)的报道已经足够充分,但是从对环境和人类健康的考虑出发,开发更为实用的方法应以满足目前的需求是很有必要的。因此,我们使用其他的金属盐来分析Ferrier (II)反应。
我们侧重于反应的第一步,烯烃中加入水,类似汞一样搜索催化含氧金属化的过渡金属。结果,我们发现二价钯具有良好的活性,尤其是,氯化钯的催化活性和三幅乙酸汞一样高。Adam 1988年报道过Ferrier (II)反应中氯化钯的应用9) ,但是对其一般的应用没有讨论。10) 然而,因为这个反应实在中性溶剂中进行,所以没有副反应比如说含氧官能团的β-消除,或者是阻塞基团的消除。此外, 氯化钯易于处理。基于这些方面,我们选择氯化钯作为Ferrier (II)反应催化剂。
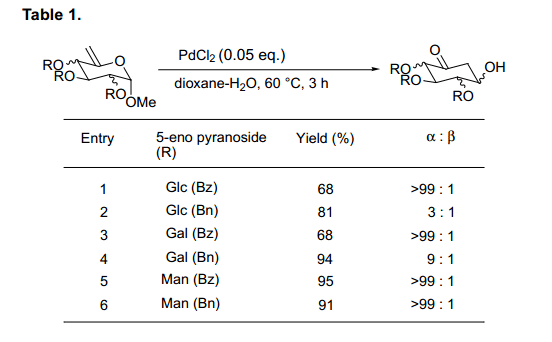
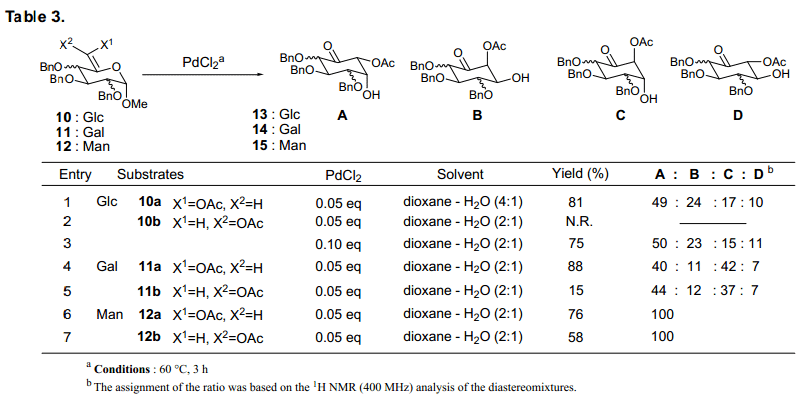
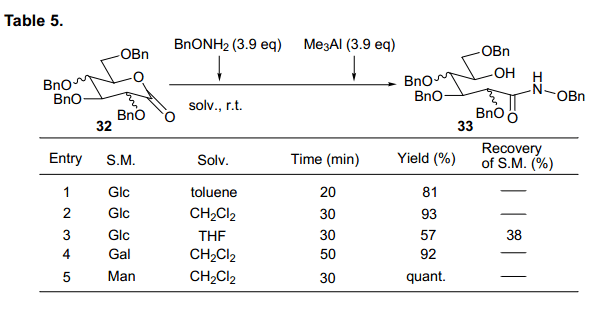
虽然最初氯化钯的稳定性是一个问题,我们发现这个化合物在水合二恶烷中保持稳定。如图表1所示, 从葡萄糖、半乳糖和甘露糖而来的各种基质衍生物,与0.05当量的氯化钯反应转换为环己酮,产品收益率高。
由葡萄糖和半乳糖的来的5-烯吡喃糖苷表明了在苯甲酰基和苄基形式之间有反应性差异。此外,我们发现新形成的羟基基团立体化学选择性与每一个基质相随 (条目1-4)。相反,甘露起源的基质在保护集团中不显示任何的差异,与α-选择性得到相应的环己酮(条目5, 6)。
环完全转换通过(0.05 equivalent)当量的氯化钯催化剂。这个反应比以往的转换方法更具优势,因为:1)它非常普遍并且适用于各种糖类的环转换,2)反应在非常温和的条件下进行,3)反应中通过不同的立体化学选择性产生的各种异构体来源于不同于汞化反应的同一种化学机理 。此外,因为氯化钯催化剂和溶剂都不需要提纯,所以这个反应实用,并且可以应用到工业生产中。利用这些优点,我们产用这个方法来完成生物活性化合物的全合成。
3.2 Cyclophellitol11)的全合成
Cyclophellitol 是一个由Umezawa等人在1990年分离出来的一个β-D-葡萄糖苷酶抑制剂。12)近年来, 人们发现糖相关酶与细胞内识别密切相关,13)这些酶抑制剂一直被用来重点研究各种疾病的治疗药物方面。14 )特别是,Cyclophellitol具有很高的活性,它的应用有望延伸到制作防病毒和抗-HIV剂抑制癌细胞的扩散。15)Cyclophellitol的结构是一个在葡糖糖构像多取代环醇β –位置上类似β-D-葡糖苷的环氧环。16) Cyclophellitol合成方法已经被广泛应用到世界各地。17)我们不仅仅研究cyclophellitol也包括它的差向异构体的合成方法,最终的目的是构效关系的研究。
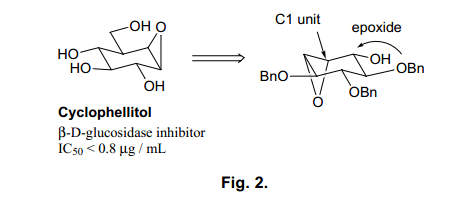
Fig. 2显示了cyclophellitol和它的差向异构体的合成方案。在Ferrier (II)反应中,糖类用作初始基料转化为环己烷环,然后形成一个立体选择性环氧环。然后利用区域选择性和立体选择性亲核加成环氧环,一个羟甲基基团被引入如图C1位置。最后,进行消除反应形成一个β-构型环氧环来完成cyclophellitol的全合成, 其中所有的取代基都由立体化学来控制。这条线路可以允许cyclophellitol多种差向异构体的合成。
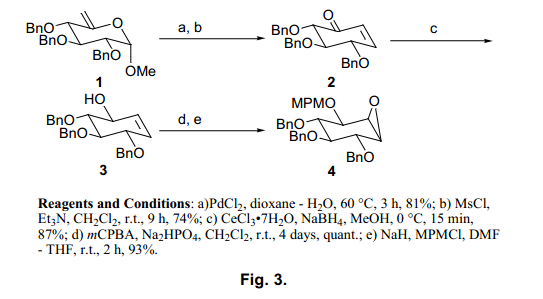
在我们的试验中,5-烯醇吡喃葡糖苷118)在Ferrier (II)反应通过常规方法首先得到(利用氯化钯催化剂得到环己酮)。环己酮通过消除反应转换为烯酮2。烯酮2在Luche’s条件19)下还原得到β-醇3。然后α-型环氧物立体选择性构象形成, MPM基团保护羟基得到中间体环氧化物4(图3).
在全合成途径中关键反应是区域选择性和亲核加成进攻环氧化物4羟甲基基团。一般情况下,环己烷的开环反应中亲核试剂主要进攻环氧化物的轴向位置。20)因此, 我们预计亲核取代环氧化物将在轴向位置,C5处,并且不显示所需的区域选择性21) (图4).
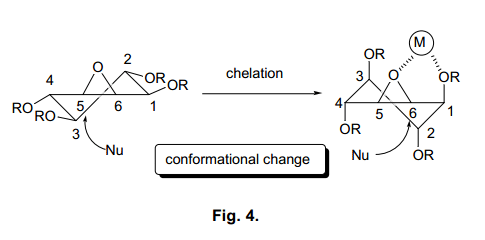
我们设想如果我们能够改变环氧化物的构象,那么我们就能够在C6位置引入羟甲基基团 。
换言之,如图4所示, 环氧化物中金属和氧原子之间的螯合和醚可能直接改变环己烷环的构象,从而导致轴向亲核进攻的位置在C6处,而不是C5处。对于这样的,我们使用一个硼酸试剂来取代羟甲基,来研究环氧化物使用基料在被保护位置C1(利用各种保护剂,同位进攻)区域选择性(表2)。22)
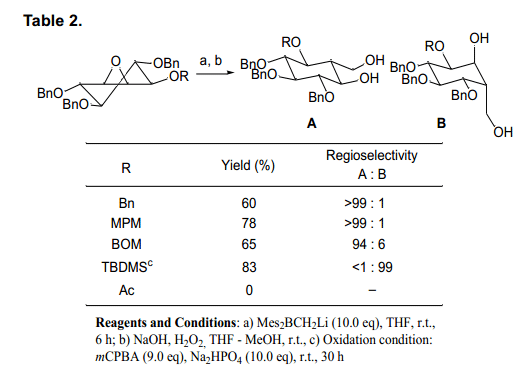
遗憾的是,由于酰基保护基团和硼酸试剂反应,我们没有得到羟甲基的加成产物。然而,羟甲基与基板上的保护基团醚以很高的速率发生反应。非常有趣的是,基质由苄基保护,在相反的位置由于螯合作用MPM 和BOM基团生成羟甲基产品A,但是保护基团是TBDMS 时生成B。我们假设巨大的TBDMS基团可能会阻止醚氧原子,这样的结果,那么环己烷结构不会发生转换。基于这些结果,我们选择了MPM 作为做为最合适的保护剂,并进行了如下图所示的合成(图5)。
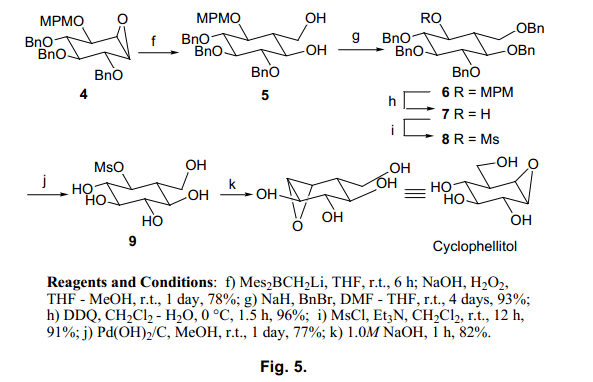
羟甲基化后得到二醇5,它由苄基基团保护,并且甲基与一个MPM基团进行交换。然后,所有额苄基通过催化氢化脱保护得到五醇9。五醇在碱性条件下很容易的进行环氧化物环化反应,Cyclophellitol 从原料1最终合成,总收益率在14%。
在这个合成方法中,初始糖类很容易的导致各中差向异构体,这取决于糖类的构象和保护基的类型。同样的方法,C3处一个不同的排列,可以成功的得到Cyclophellitol的一个差向异构体。23)
3.3 肌醇异构体的合成24)
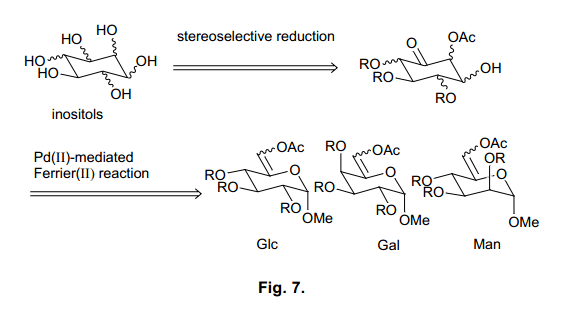
肌醇是动物和植物中都能发现的生物活性化合物之一,在细胞的增值和癌变中表现出多种功能。25)这里共有九中类型的肌醇立体异构体(图6), 因为在细胞内信号转导途径研究的最新进展,myo-肌醇得到了广泛的关注。26,27)
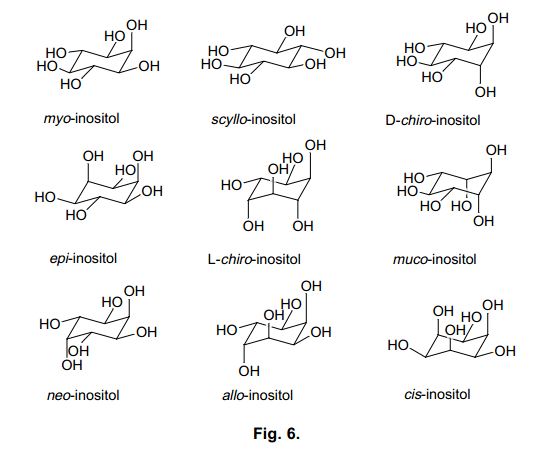
例如, 细胞外刺激反应,myo-肌醇-1,4,5-三磷酸[Ins(1,4,5)P3]调动Ca2+浓度增加。28)此外,myo-肌醇-1,3,4,5-四磷酸[Ins(1,3,4,5)P4]从细胞外围中接收Ca离子。29)由于肌醇多聚磷酸盐通过这种机制通过改变细胞内Ca离子浓度发挥不同的功能,它们被称为第二信使。尽管更多的myo-肌醇多聚磷酸盐被发现,但是由于他们的浓度低,难以隔离,它们的激活机制还是难以琢磨。30) 因此,得到肌醇衍生物作为肌醇受体的配体十分必要。31) 然而,只有四种天然存在的肌醇异构体(scyllo-,neo-, D-手性-, L-手性-肌醇)可以作为myo-肌醇类的激动剂或者是拮抗剂,其他的四种(cis-,allo-,epi-和muco-肌醇)只能通过化学合成获得。其中,有两种类型容易获得,但是它们非常的昂贵。这完全归因于肌醇异构体罕见的结构和合成方法的不实际性。为了建立一个简易的合成方法,来合成这九种类型的肌醇异构体包括其中我们之前没有关注过的类型,我们设计了一个合成途径如图7所示。.
这条线路,我们预期含有一个乙酰氧基的5-烯吡喃糖苷通过Ferrier (II)反应在C6位置江北转换为环己酮,环己酮中的酮部分被还原产生一个肌醇骨干。32)利用从葡萄糖、半乳糖、甘露糖衍生得到的基料,这个方法在同时间内将会产生种类繁多的异构体。
3.3.1 6-O-乙酰基-5-烯吡喃糖苷的Ferrier(II)反应审核
首先,Ferrier (II)反应6-O-乙酰基-5-烯吡喃糖苷与基料反应,用实验当量的氯化钯做催化剂进行检测。我们尤其关注烯醇酯在立体化学方面的影响,对E-型在反应性和立体选择性上面进行了比较(表3)。
葡糖糖衍生物基料10 Z-型比其E-型的反应性高,并且生成了四个对应立体邮购提混合物。D-半乳糖起始物11也出现了类似情况。对于每一个糖类,从Z-型或者是E-型得到的四核环己酮的比率在C6构象上是没有任何影响的。当使用甘露糖衍生物基料12时,Z-和E–型都得到一个单一的环己酮构象。这些结果的基础上,我们发现任何糖类都有效地进行着环转换。我们还发现根据原始糖类的构象,环己酮形成的比率不同,基料上C6位置的构象不会保留,并且C6不会影响新的手性中心构象。33)我们也分析了反应中使用Hg++, 但是慢于氯化钯催化反应,并产生不同比率的异构体。因此,我们得出结论,氯化钯竟会带来一个令人满意的效果,并进行下一步的讨论。
3.3.2 立体选择性还原反应的审核
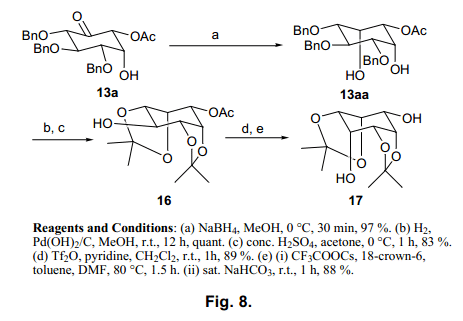
我们测试了两种还原方法得到环己酮(表4)。当使用Me4NHB(OAc)3时34),除了和其他的反应,在14c (条目11)中不能继续进行,生成的醇在羰基β–位置处被反式方式还原。尤其是与13a、13c、14a、15a 反应立体选择性非常高,仅得到β-型,产率很高。我们认为是羰基β–位置处的羟基还原的原因。另一方面,当使用硼氢化钠时,反应在空间位阻小的位置进行,13a, 14a, 14b, 14c和15a高选择性的还原产物。因为这两个还原反应彼此互补,所以通过改变反应可以轻松得到所需醇。因此,这个立体选择性的方法让我们得到了所预期的九分之八的肌醇。最后一个异构体,cis-肌醇通过13a获得(通过葡萄糖衍生物的环转换,产率很高)。

如图8所示,13a中的酮通过硼氢化钠还原只得到α-型醇13aa,产率很高。然后,苄基脱保护,缩丙酮基团用于选择性保护cis-二醇。最后一个羟基集团反转得到cis-肌醇衍生物17。这些肌醇衍生物脱保护,被证实了,与先前报道的天然存在的衍生物具有相同的值。36)
因此,我们成功的立体选择性合成了肌醇的所有立体异构体。该方法使用利用氯化钯作为催化剂的Ferrier (II)反应制得的多种环己酮异构体,能够同时合成多种异构体,这是使用汞化盐所得不到的。
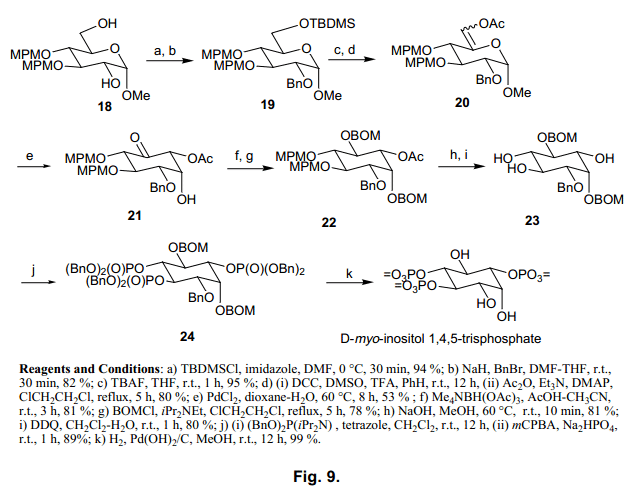
3.4 肌醇多聚磷酸盐的合成
接下来,我们合成Ins(1,4,5)P3和Ins(1,3,4,5)P4, 如图9、10.所示。用这个方法得到的Ins(1,4,5)P3和Ins(1,3,4,5)P4 显示出来的值与天然存在的化合物一致,37,38) 我们对其结构也进行了确认。
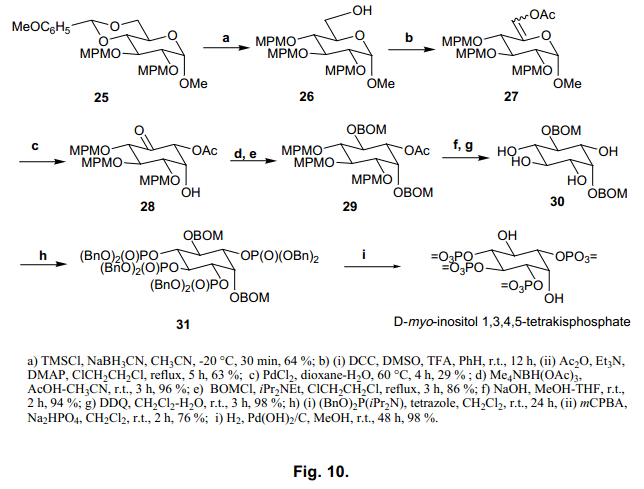
接下来的部分,我们将描述内酯糖对合成各种生物活性化合物和糖链的有效应用。
4.葡萄糖-D-内酯合成L-糖的应用39)
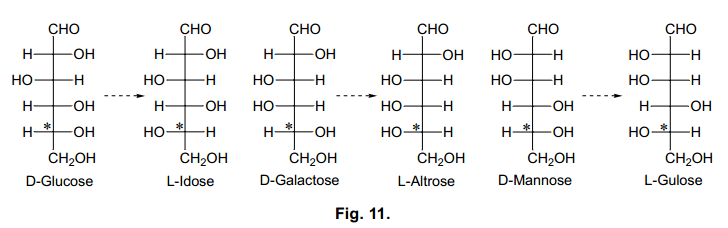
自然界中L-糖少有产生,但有趣的事,在生物活性化合物的活性方面它往往扮演者一个关键的角色。40)然而,它很稀有,并且合成方法尚未建立,L-糖的研究远远落后于D-糖。为了克服这种情况,使得L-糖像D-糖一样得到发展,我们制定目标设计制备L-糖的实用方法。 为了接近化学合成,我们试图在C5位置处有效地将D-型转换为L-型。
如图11所示,D-葡萄糖在C5处转换为L-艾杜糖,D-半乳糖转换为L-阿卓糖。尽管L-艾杜糖和L-古洛糖都是有市售的,但是它们非常的昂贵。L-阿卓糖没有销售市场。我们的方法是利用廉价易得到的D-糖通过简单的步骤来有效地合成L-糖。我们试图通过甘油-D-内酯羟肟衍生物分子内环化和合成L-糖(Mitsunobu反应),这是一个D-糖在C5位置典型的SN2-型反应。
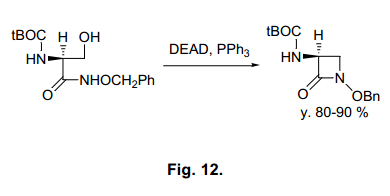
Miller等人已经报道了氨基酸β-羟基异羟肟衍生物的分子内环化反应。41)这个反应已经广泛应用在各种β-内酰胺抗生素的合成上面,因为亲核进攻酰胺氮原子主要生成β-内酰胺(图12)。然而,不仅仅是酰胺氮原子,还有羰基氧也会进攻化合物。事实上,其他的基板可能会产生内酯,42) 我们感兴趣的是糖衍生物基板被使用过后的结果(图13).
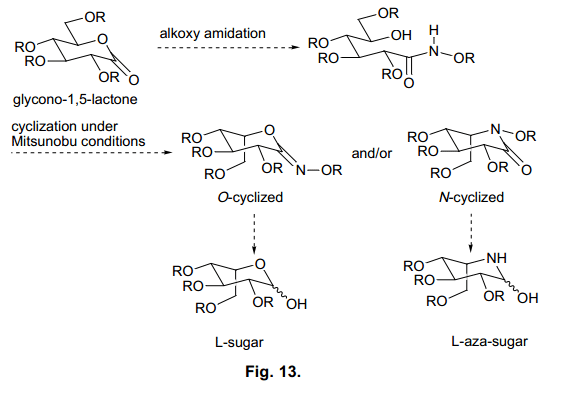
如图13所示,亲核进攻酰胺N原子生成N-环化物,亲核进攻氧原子得到O-环化物。在这种情况下,Mitsunobu反应在C5反转生成环化物;N-环化物得到L-氮杂糖, O-环化物生成L-糖。基于这一步骤,我们分析了D-glycono-1,5-lactones的δ –羟基烷草酰胺衍生物的分子内环化。
基板δ-羟基异羟肟衍生物通过D-葡萄糖吡喃内酯、D-半乳糖吡喃内酯、D-甘露糖酸吡喃内酯与苄胺反应合成。我们预测该反应可由路易斯酸促进反应,并且发现三甲基铝对高产率合成δ-羟基异羟肟衍生物起到一个显著的加速效果,如图5所示。43)同样的,烷氧基盐酸盐证明了在有效合成δ-羟基异羟肟衍生物时显示出很高的产率。根据这些,我们利用Mitsunobu 反应分析了化合物的环化反应。
环化进程迅速,得到O-环化和N-环化δ-羟基异羟肟衍生物,产率分别为71%和13%,O-环化是N-环化产率的5.5 倍。这与Miller等人在β-内酯的获得结果上不相同。D-半乳糖衍生基质也主要生成O-环形式。有趣的是,D-甘露糖主要产生O-环化物而不是N-环化物。基于这样的结果,我们发现糖类δ-羟基异羟肟衍生物主要优先生成O-环型,尽管从O-型到 N-型环化物的产率比随着初始糖的类型而改变。此外,溶剂影响的详细分析表明,O-型到N-型环化物的产率比随着使用溶剂D-葡萄糖和D-半乳糖的溶剂类型改变而变化。这个环化反应的简易机制如图所示(图14).
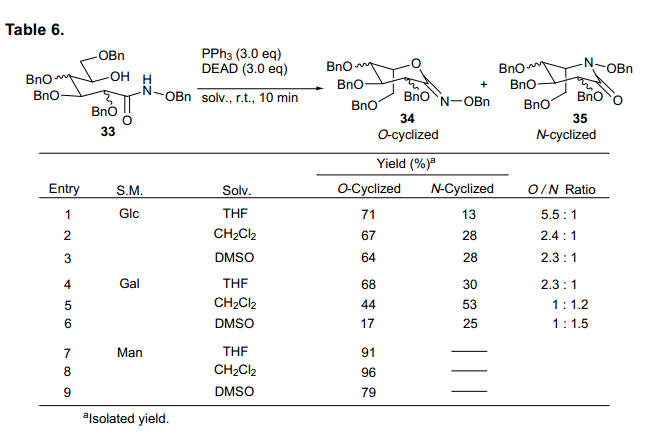
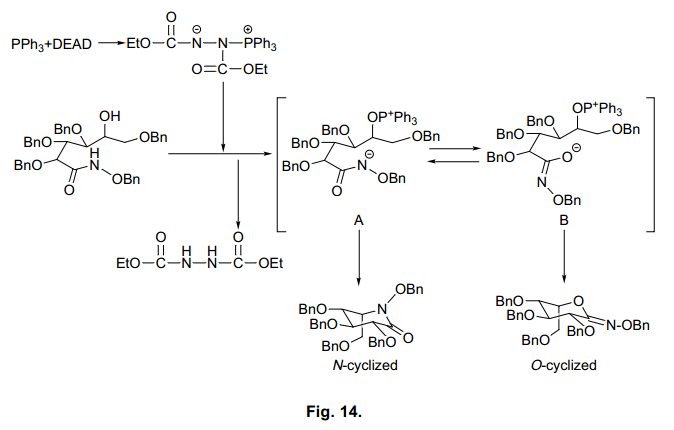
首先,复合物控制通过Mitsunobu试剂使得δ-羟基异羟肟衍生物的酰胺氢生成中间体A ,其氮原子上含有一个负离子电荷。在C5处亲核进攻氮原子生成N-环化产品。另一方面, 中间体A通过负电荷转移到氧原子上面生成中间体B。亲核进攻氧原子生成O-环化产品。目前为止原因尚不清楚,但是当使用δ-羟基异羟肟衍生物时,通过中间体B形式的环化反应占主导。
如果我们使用任何糖类合成L-吡喃糖,优先得到的是O-环化型(图15)。
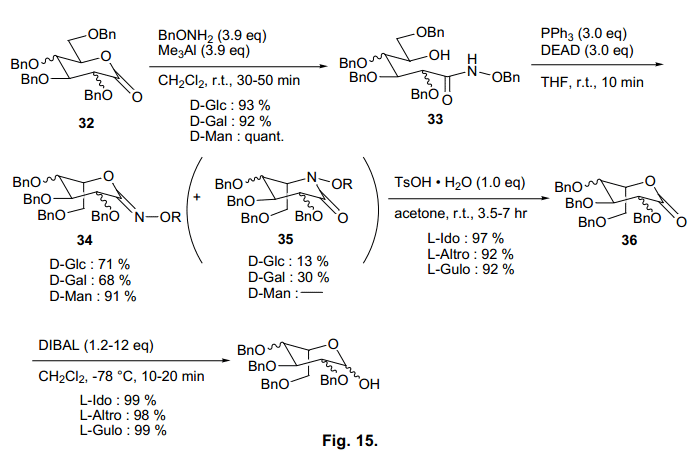
由于O-环化品34(这三种糖衍生物)在L-吡喃丙酮C1处脱保护, 所以我们在酸性条件下脱保护分别制得L-idonolactone衍生物,L-altronolactone衍生物和 L-gulonolactone衍生物,产率很高。然后, C1位置羰基被DIBAL还原,分别有效地获得L-艾杜糖, L-阿卓糖和L-古洛糖衍生物。特别是,通过这四步,显示得到83%的D-甘露糖,证明了这个方法的高效性。最终的产品L-吡喃衍生物仅在C1位置不受保护,因此可以进一步用于糖基化。因此,我们首次建立了从稀有L-糖制备D-糖的简易廉价合成方法。
接下来,我们试图通过此幻化方法,从L-核糖合成糖1,4-内酯衍生物(图16)。L-核糖是D-核糖的对应异构体,自然界中少有产生。最近,L-核糖的合成方法得到了越来越多的发展,因为含有L-核糖的化合物显示出各种生活活性包括病毒影响。44)
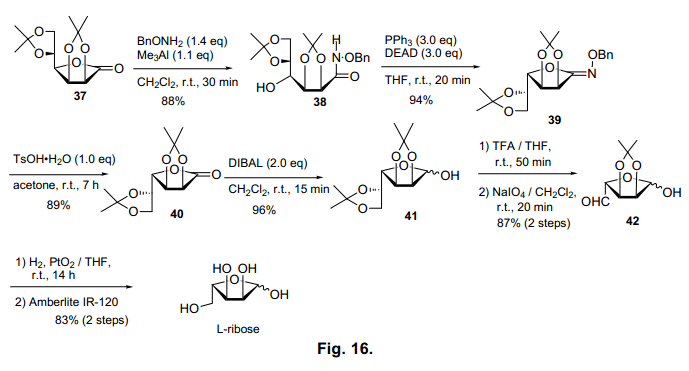
L-核糖的合成基于同样的方案。内酯37由市售产品D-甘露糖-1,4-内酯常规方法衍生而得,环裂解后,通过Mitsunobu反应再次环化。在这个方法中,仅仅有O-环化物39生成(C4位置倒转),没有N-环化产品物。我们认为甘露糖衍生物1,5-内酯得不到上述的N-环化产物,我们得出的结论是,在这个方法里甘露糖只专门生成O-环化产物。虽然尚未不能明确的证明,但是糖C2 位置的羟基集团构象似乎影响O-和N-环化产物的比例。特别是, D-甘露糖-1,4-内酯有利于合成L核糖, O-环化物得到后,39在C6处被氧化切割,通过几个步骤就可以有效地得到L-核糖。
如上所述,这个方法可以由N-环化物派生出氮杂糖(分子间环化反应的副产物),因此,糖相关酶的抑制剂可能应用到。
5. 利用糖原酸酯合成糖衍生物
糖原酸酯是通过糖内酯和糖二醇组合形成螺环而得。他们独特的结构最初是在一系列orthosomycin抗生素中发现的。45)这种来自于糖苷键的独特的特性键,用来研究rthosomycins的合成和结构分析,专注于临位酯键形成的方法。其结构是,糖原酸酯本身的结构特性和反应性和他们的应用已经have been left unknown。然而,这个特定反应性的战略应用对有效合成方法的进展和使用原酸酯作为糖固定结构似乎成为可能。从这一个角度来看,我们分析糖原酸酯的各种合成方法旨在表征这些化合物和他们的反应性。
5.1糖原酸酯的高效合成方法的发展46)
在我们刚开始的研究中,糖原酸酯的合成报道很少,并且有效合成糖原酸酯的数量也很少。因此我们试图开发更为有效地方法。通过由Miyat等人分析缩酮的合成方法, 47)我们发现在过量的methyl trimethylsilyl ether (TMSOMe)和一定数量的trimethylsilyl triflate催化剂的存在下,糖原酸酯从糖内酯和二醇中有效地生成。利用甲苯在反应中减压条件下提高产率,除去副产物甲醇和六甲基二硅氮烷,当使用相当量的内酯和二醇时生成各种糖原酸酯(图17)。
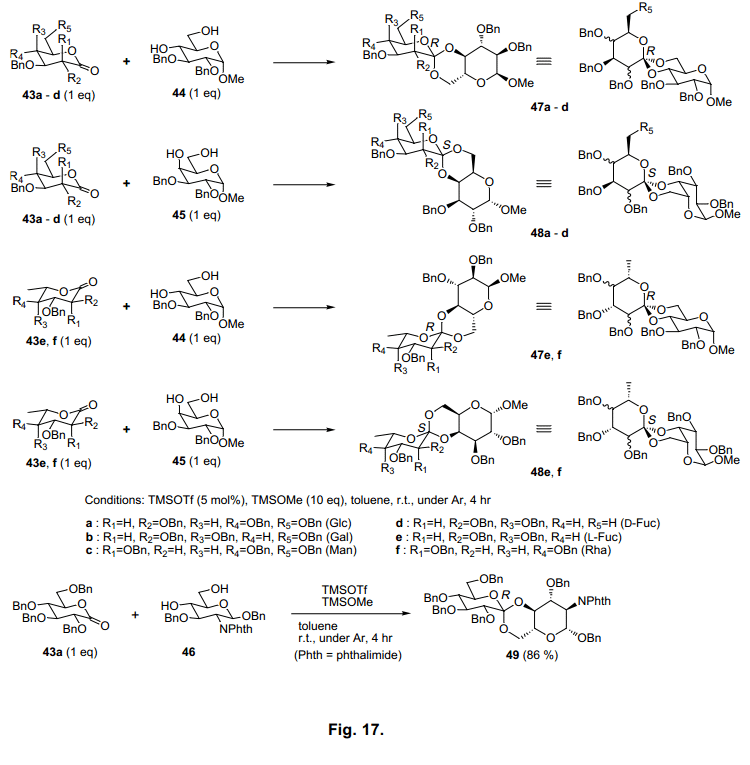
基于螺碳周围的结构,糖原酸酯形成两个异构体。这两种异构体中的任何一个都会有选择性的生成糖原酸酯(47a-f,48a-f, 49)。
5.2 糖原酸酯的结构分析48)
用X-ray 分析团原酸酯的两种异构体的结构是必须的。我们使用电脑结合投射分析和构象分析分析了糖原酸酯的结构。
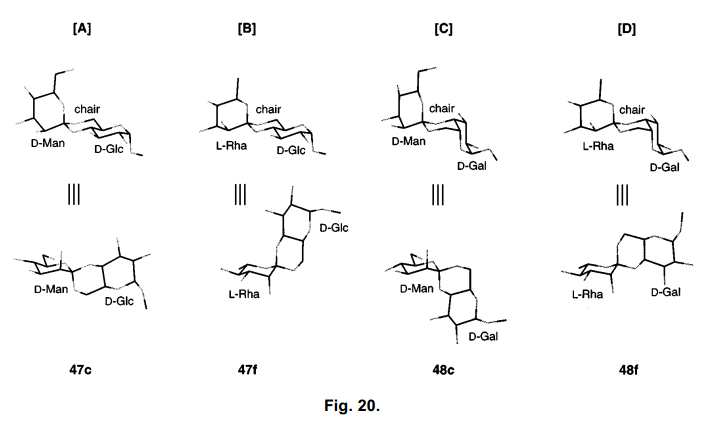
前一节中我们对邻位酯和吡喃二恶烷的3-环骨架的描述,我们用X-射线分析了47c以及47f、48c、48f (50-52)等的乙酰衍生物的晶型,螺碳的构象被分别的确定为R、R、S、S。(图18)

接下来,假定我们得到R和S-构象,我们估计通过使用使用LOMD方法50)由特定的力mm2*在MacroModel 6.049)得到的原酸酯的构象是最为稳定的。更为稳定的构象是通过计算每一个糖原酸酯的构象能量来确定的。在每一个化合物中,两个异构体之间的能量差别足够的大, 47a-f螺碳确定是R-构型,而48a-f确定为S-构型。这个结构与Yoshimura等人报道的数据一致。51)
糖原酸酯结构计算的分子透露了两个构象能量差异源于它们环结构骨架的稳定性差异。图19显示47c的设定R-与S-异构体的环结构骨架。R-构型, 甘露糖吡喃环氧原子与中心手性二恶烷成轴向,估计会更加稳定,由于端基异构体的效果,这种构象被大大的优先选择。52,53) 同样的,其他的11种糖原酸酯,这些构象中的其中任何一个酯结构都比其他的要稳定。据推测,不利的异构体具有一个扭曲的船型构象二恶烷填补在吡喃环的赤道轴位置,如图19所示。

这些结果表明,一定范围内的羟基构象的差异,不影响吡喃环的结构,也不影响螺碳和优选结构骨干的构象。因此,合成的糖原酸酯可以分为四个结构基团:glycosyliden的D-或者是 L-型,二醇中的葡萄糖或者半乳糖。例如,图20显示从两个方向观测47c、47f、48c、48f的结构。此外,与47a相关的49的构象的分析,估计其具有A-型环结构。
5.3 糖原酸酯还原糖基化的发展54)
围绕糖原酸酯结构分析的有机化学方法,其反应性鲜为人知。我们分析糖原酸酯与氢和甲基阴离子的反应性有望开发一个新的合成方法。图21 显示了阴离子与糖原酸酯反应的广义方程式。
阴离子进攻,在a-位置裂解环生成缩醛或者是缩酮化合物,而在b-或者c-位置处裂解则生成糖苷。每一个产品在新形成的手性中心都有两种构象。如果哦我们能控制区域选择性开环和阴离子立体选择性进攻,那么我们就可以研发出一个新的合成方法。尽管在研究糖基化发展中激活糖供体已经收到关注55),我们尝试合成糖链更为灵活的方法。
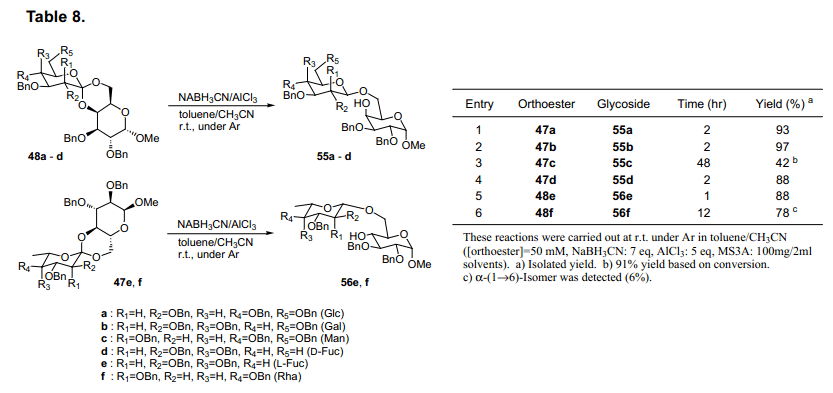
当糖原酸酯47a被氢离子还原,会有四种可能的产物具有其中α(1→4),β(1→4),α(1→6)或β(1→6)键。当我们评估各种还原试剂的有效性、区域选择性和立体选择性的时候,发现ethermethylene chloride 中两种等量的LiAlH4和AlCl356)选择性从47a生成β(1→4)糖苷53a产率92%(表7, 条目1)。这种情况下,其他三种预测的糖苷没有生成,表明了其高区域选择性和立体选择性反应。使用这个方法,糖原酸酯47b-d, 48e和f还原产率为92-99%,并选择性生成β (1→4)糖苷53b-d, 54e和f (表7)。然而,其他的糖原酸酯47e, f和48a-d的还原不能有效的进行。进一步评估还原剂,我们发现氰基硼氢化钠和氯化铝在甲苯-乙腈57)中有选择地产生β(1→6糖苷55a-d,56e和f(表8)。然而,当我们采用这种方法合成糖原酸酯47A-D,48E和F时,它没有给出合适的产品。
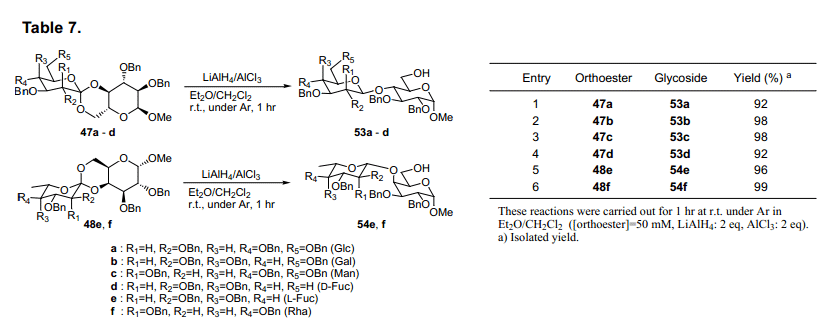
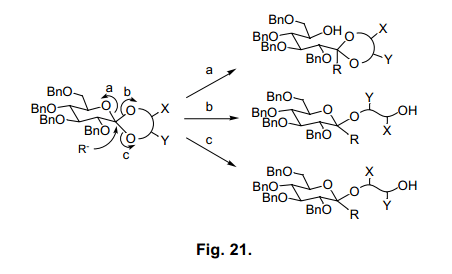
这些糖原酸酯中所发现的反应性差异可以通过上述构象差异来进行简单的解释。47a-d, 48e和f 骨干环结构预计为A或者D型,如图20所示。图的末端二醇环C6处氧原子与内酯吡喃环成轴向。另一方面,化合物47e, f和48a-d预计具有B或者C型,如图20,但是C4氧是轴向。由于极端异构体的影响,我们推测吡喃环在轴向比在赤道位置具有更高的反应性58), 但是如果使用适当的还原剂,由轴向裂解而得的糖原酸酯会优先获得。
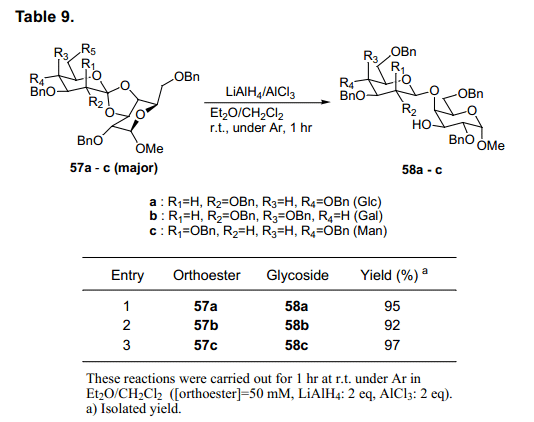
我们也进行了糖原酸酯57a-c通过使用还原试剂LiAlH4/AlCl3的还原反应。当57a-c主要形式使用时,预计轴向位置C3氧原子, 可以选择性的还原生成β(1→4)糖苷58a-c,产率92-97% (表9)。
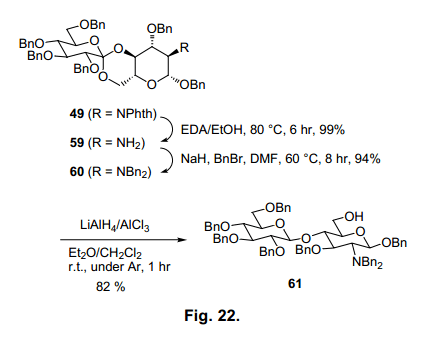
在这个还原条件下,57a-c的次要形式几乎不进行反应。因此,当该产品不进行异构体分离就用于还原反应,那么生成的β(1→4)糖苷不具有任何实在问题。如图22所示,邻氨基葡萄糖酯也进行了分析。49转换为二苄基保护形式60后,通过 LiAlH4/AlCl3还原反应选择性生成β(1→4)糖苷61。不幸运的是,具有邻苯二甲酰亚胺的葡萄糖胺49 或者不受保护的氨基基团59都不适合做反应的基料。
这个糖基化方法中最有趣的一方面就是β-甘露糖苷和β-鼠李糖苷的获得都具有很高的选择性。传统的方法很难生成cis-1,2-β-糖苷,但是新的方案就允许β-糖苷从甘露糖或者鼠李糖中选择性生成。原酸酯的形成和还原产率都是很有效的,并且等同或者高于其他合成cis-1,2-β–糖苷的方法。59-60)
6. 糖原酸酯合成卡巴糖方法的发展61)
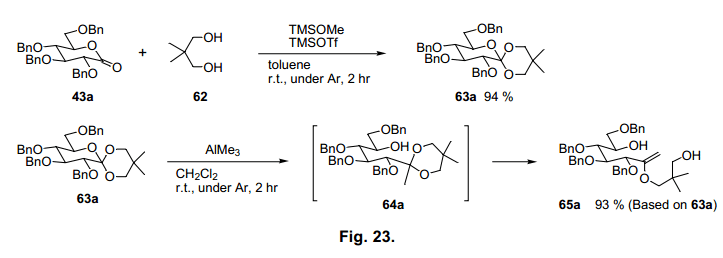
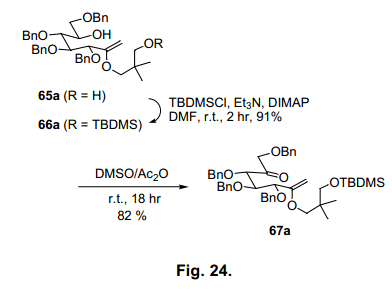
如前所述,合成环醇的各种方法已被广泛的研究。我们开发了一个利用原酸酯和甲基阴离子反应,合成卡巴糖的一个简单的合成方法。过量的 糖原酸酯63a和三甲基铝反应,预计有一个甲基阴离子供体,得到烯醇醚化合物65a,产率93% (图23),由于缩酮64a分离作为中间体,反应初始步骤必须通过引入甲基阴离子进行环裂解图21所示。接着二恶烷环碳氧裂解62)伴随三甲基铝质子化 生成烯醇醚65a。烯醇醚65a具有七个碳原子,因此用作于卡巴糖的前体。我们试图将65a 转换为aketone 67a (图24),通过羟醛缩合形成环己烷。63)
我们发现加热两种等量的氯化锌在水合四氢呋喃64)可以将67a转换为卡巴糖68a,产率90% (表10,条目5)。
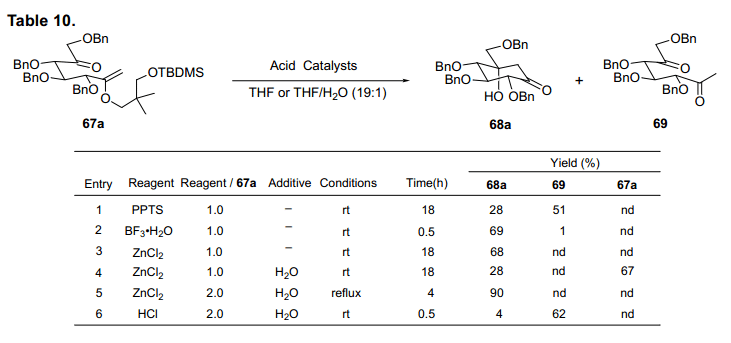
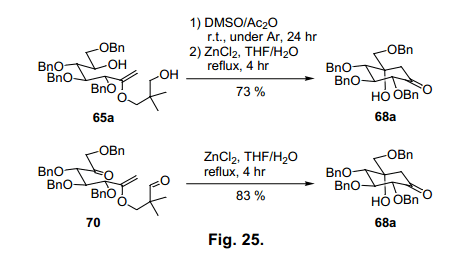
条目3中,当氯化锌用在脱水溶剂中,反应加速但是有副产物生成,因此所需化合物产率降低。然而,少量水加入,就会生成高产率的68a(条目5)。此外,盐酸加入水合tetrahydroflan,主要生成二酮69(条目6)。当我们省去甲硅烷基保护简化程序使用烯醇醚65a 直接氧化的粗产物用于羟醛缩合反应,得到68a产率73%(图25).
第一氧化反应主产物是二羰基70, 接着隔离和羟醛缩合反应后,酮选择性转换为68a (图25)。同样半乳糖43b和甘露糖43c内酯生成卡巴糖68b和c,产率分别为64%和56% (图26)。
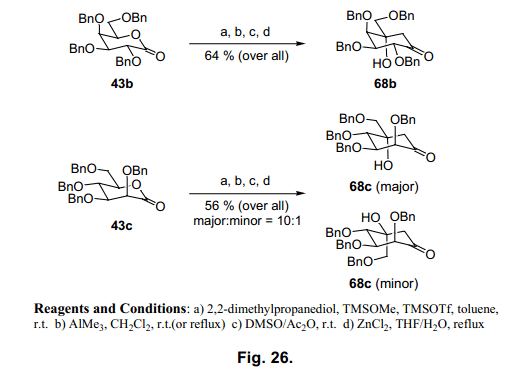
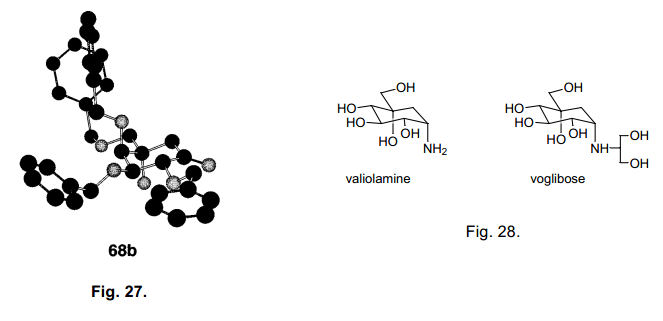
当使用68c时,羟醛缩合环化生成两种异构体10:1。两种异构体68b和68c构象通过X-射线分析图27),通过环状苯基硼衍生物的形成。65)68a 是一个合成valiolamines衍生物非常有用的synton,66-67) 我们也合成voglibose (图28), 一个糖尿病药物,根据Fukase的方法。68)
7. 结语
虽然本文中所述方法目标都是合成糖类,我们仍然通过这些方法以及新的合成方法关注通过常规反应的糖烯醇或内酯的合成。糖类是廉价并且易获得的光学活性化合物资源。我们相信这些糖类的方案可以极大的促进医药化学和有机合成化学的发展。
References
1 Bols M., “Carbohydrate Building Blocks”, John Wiley & Sons, Inc., New York, 1996.
2 Iimori T., Takahashi H., Ikegami S., Tetrahedron Lett. , 37, 649 (1996).
3 a) Ferrier R. J., J. Chem.Soc., Perkin Trans.1, 1455 (1979). b) Ferrier R. J., Chem. Rev., 93, 2779 (1993).
4 Ito H., Motoki Y., Taguchi T., Hanazawa Y., J. Am. Chem. Soc., 11 5 , 8835 (1993).
5 Chida N., Ogawa S., Yuki Gosei Kagaku Kyokaishi (J. Synth. Org. Chem. Jpn.), 53, 858 (1995).
6 Wong Y-H. H., Sherman W. R., J. Biol. Chem., 261, 11083 (1985).
7 Mechado A. S., Olesker A., Lukacs G., Carbohydr. Res., 135, 231 (1985).
8 Chida N., Ohtsuka M., Ogura K., Ogawa S., Bull. Chem. Soc. Jpn. ,64, 2118 (1991).
9 Adam S., Tetrahedron Lett., 29, 6589 (1988).
10 The glucosamine-derived substrates are studied, but the yield is not high. László P., Dudon A., J. Carbohydr. Chem. , 11, 587(1992).
11 Takahashi H., Iimori T., Ikegami S., Tetrahedron Lett., 39, 6939 (1998).
12 a) Atsumi S., Umezawa K., Iinuma H., Naganawa H., Nakamura H., Iitaka Y., Takeuchi T., J. Antibiot., 43, 49 (1990). b) Atsumi S.,Iinuma H., Nosaka C., Umezawa K.,J. Antibiot.,43, 1579 (1990).
13 Sinnott M. L., Chem. Rev., 90, 1171 (1990).
14 a) Jespersen T. M., Dong W., Sierks M. R., Skrydstrup T., Lundt I., Bols M., Angew. Chem., Int. Ed. Engl., 33, 1778 (1994). b)Knapp S., Naughton A. B. J., Dhar T. G. M., Tetrahedron Lett. , 33, 1025 (1992). c) Schmidt D. D., Frommer W., Junge B., MullerL., Wingender W., Truscheit E., Naturwissenschaften, 64, 535 (1977). d) Itoh J., Omoyo S., Shomura T., Ogino H., Iwamatsu K.,
Inouye S., J. Antibiot. , 34, 1424 (1981). e) Yokose K., Ogawa K., Sano T., Watanabe K., Maruyama H., Suhara Y., J. Antibiot. , 36,1157 (1983).
15 a) Saunier B., Kilker R. D., Tkacz J. S., Quaroni A., Herscovics A., J. Biol. Chem., 257 , 14155 (1982). b) Pan Y. T., Hori H., SaulR., Sanford B. A., Molyneux R. J., Elbein A. D., Biochemistry , 22, 3975 (1983).
16 a) Atsumi S., Nosaka C., Ochi Y., Iinuma H., Umezawa K., Cancer Research , 53, 4896 (1993). b) Tatsuta K., Niwata Y., Umezawa.K., Toshima K., Nakata M., Carbohydr. Res., 222 , 189 (1991).
17 a) Tatsuta K., Niwata Y., Umezawa K., Toshima K., Nakata M., Tetrahedron Lett., 31, 1171 (1990). b) Tatsuta K., Niwata Y.,Umezawa K., Toshima K., Nakata M., J. Antibiot. , 44, 912 (1991). c) Vincent W. F. T., Fung P. H., Wong Y. S., Shing T. K. M.,Tetrahedron: Asymmetry, 5 , 1353 (1994). d) Nakata M., Chong M. C., Niwata Y., Toshima K., Tatsuta K., J. Antibiot. , 46, 1919(1993). e) Moritz V., Vogel P., Tetrahedron Lett. , 33, 5243 (1992). f) Shing T. K. M., Tai V. W. F., J. Chem. Soc., Perkin Trans. 1,2017 (1994). g) Schlessinger R. H., Bergstrom C. P., J. Org. Chem. , 60, 16 (1995). h) Mcdevitt R. E., Fraser-Reid B., J. Org.Chem., 59, 3250 (1994). i) Shing T. K. M., Tai V. W. F., J. Chem. Soc., Chem. Commun. , 995 (1993). j) Akiyama T., Ohnari M.,Shima H., Ozaki S., Synlett, 831 (1991).
18 Semeria D., Philippe M., Delaumeny J.-M., Sepulchre A.-M., Gero S. D., Synthesis, 710 (1983).
19 Gemal A. L., Luche J. L., J. Am. Chem. Soc., 103 , 5454 (1981).
20 Eliel E. L., Allinger N. L., Angyal S. J., Morrison G. A., Conformational Analysis., Wiley: New York. 1965, 352.
21 a) Pelter A., Bugden G., Rosser R., Tetrahedron Lett., 26, 5097 (1985). b) Pelter A., Singaram B., Warren L., Wilson J. W.,Tetrahedron, 49, 2965 (1993).
22 Similar analysis was conducted by Frost et al. Montchamp J. L., Migarud M. E., Frost J. W., J. Org. Chem., 58, 7679 (1993).
23 Data not shown.
24 a) Takahashi H., Kittaka H., Ikegami S., Tetrahedron Lett. , 39, 9703 (1998). b) Takahashi H., Kittaka H., Ikegami S., TetrahedronLett. , 39, 9707 (1998).
25 a) Sasaki K., Loewus F. A., Plant Physiol., 69, 220 (1982). b) Sasaki K., Taylor I. E. P., Plant Cell Physiol., 25, 989 (1984). c)Sasaki K., Taylor I. E. P., Plant Physiol., 81, 493 (1986).
26 a) Michell R. H., Biochim Biophys. Acta, 415 , 81 (1975). b) Berridge M. J., Irvine R. F., Nature (London), 312 , 315 (1984).
27 a) Ley S. V., Parra M., Redgrave A. J., Sternfeld F., Tetrahedron , 46, 4995 (1990). b) Bender S. L., Budhu R. J., J. Am. Chem.Soc., 11 3 , 9883 (1991) c) Ley S. V., Pure. Appl. Chem., 62, 2031 (1990). d) Bruzik K. S., Tsai M-D., J. Am. Chem. Soc., 11 4 , 6361(1992). e) Watanabe Y., Fujimoto T., Shinohara T., Ozaki S., J. Chem. Soc., Chem. Commun. , 428 (1991). f) Liu Y-C., Chen C-S.,Tetrahedron Lett. , 30, 1617 (1989). g) Ozaki S., Kondo Y., Nakahira H., Yamaoka S., Watanabe Y., Tetrahedron Lett. , 28, 4691(1987). h) Reddy K. M., Reddy K. K., Falck J. R., Tetrahedron Lett. , 38, 4951 (1997).
28 a) Steb H., Irvine R. F., Berridge M. J., Schulz I., Nature (London), 306 , 67 (1983). b) Majerus P. N., Conolly T. M., Deckmyn H.,Ross T. S., Bross T. E., Ishii H., Bansal V. S., Wilson D. B., Science, 234 , 1519 (1986). c) Putney J. W. Jr., Am. J. Physiol. , 252 ,G149 (1987).
29 a) Irvine R. F., Nature, 328 , 386 (1987). b) Irvine R. F., Moor R. M., Biochem. J., 240 , 917 (1986). c) Morris A. P., Gallacher D. V.,Irvine R. F., Petersen O. H., Nature, 330 , 653 (1987). d) Hill T. D., Dean N. M., Boynton A. L., Science , 242 , 1176 (1988). e)Changya L., Gallacher D. V., Irvine R. F., Petersen G. H., FEBS Lett. , 251 , 43 (1989). f) Joseph S. K., Hansen C. A., WilliamsonJ. R., Mol. Pharmacol., 36, 391 (1989). g) Ely J. A., Hunyady L., Baukal A. J., Catt K. J., Biochem. J., 268 , 333 (1990). h) GawlerP. J., Potter B. V. L., Nahorski S. R., Biochem. J., 272 , 519 (1990). i) Cullen P. J., Irvine R. F., Dawson A. P., Biochem. J., 271 , 549(1990). j) Molleman A., Hoiting B., Duin M., Akker J. van den, Nelemans A., Martog A. D., J. Biol. Chem., 266 , 5658 (1991).
30 Takenawa T. (ed), New development in signal transduction researches. Yodosha Co., Ltd. Tokyo (1993)
31 a) Kowarski A. R., Sarel S., J. Org. Chem., 38, 117 (1973). b) Mandel M., Hudlicky T., J. Chem. Soc., Perkin Trans. 1, 741 (1993).c) Balci M., Sütbeyaz Y., Secen H., Tetrahedron, 46, 3715 (1990). d) Billington D. C., Chem. Soc. Rev., 18, 83 (1989). e) AngyalS. J., Odier L., Tate M. E., Carbohydr. Res., 266 , 143 (1995). f) Angyal S. J., Hickman R. J., Carbohydr. Res., 20, 97 (1971).
32 Only myo -inositols have been synthesized by Ferrier (II) reaction using mercurate. Bender S. L., Budhu R. J., J. Am. Chem. Soc.,113 , 9883 (1991).
33 Yamauchi N., Terachi T., Eguchi T., Kakinuma K., Tetrahedron, 50, 4125 (1994).
34 Evans D. A., Chapman K. T., Carreira, E. M., J. Am. Chem. Soc. , 110 , 3560 (1988).
35 a) Sato K., Yoshitomo A., Takai Y., Bull. Chem. Soc. Jpn., 70, 885 (1997). b) Torisawa Y., Okabe H., Ikegami S., Chem. Lett., 1555(1984).
36 a) Angyal S. J., Ordier L., Carbohydr. Res., 100 , 43 (1982). b) Sasaki K., Hicks K. B., Nagahashi G., Carbohydr. Res., 183 , 1(1988).
37 Inositol (3,4,5) triphosphate. Lindon J. C., Baker D. J., Farrant R. D., Williams J. M., Biochem. J., 233 , 275 (1986).
38 Inositol (1,3,4,5) tetraphosphate. a) Lindon J. C., Baker D. J., Williams J. M., Irvine R. F., Biochem. J. , 244 , 591 (1987). b) CerdanS., Hansen C. A., Johanson R., Inubushi T., Williams J. R., J. Biol. Chem. , 261 , 14676 (1986).
39 a) Takahashi H., Hitomi Y., Iwai Y., Ikegami S., J. Am. Chem. Soc., 122 , 2995 (2000). b) Takahashi, H.; Iwai, Y.; Hitomi, Y.; Ikegami,S., Org. Lett., 4 , 2401, (2002).
40 a) Umezawa H., Maeda K., Takeuchi T., Okami Y., J. Antibiot. Ser. A , 19, 200 (1966). b) Sinaÿ P., Jacquinet J.-C., CarbohydrateResearch, 132 , C5 (1984).
41 a) Mattingly P. G., Kerwin J. F. Jr., Miller M. J., J. Am. Chem. Soc., 101 , 3983 (1979). b) Morrison M. A., Miller M. J., J. Org. Chem.,48, 4421 (1983). c) Miller M. J., Mattingly P. G., Tetrahedron , 39, 2563 (1983). d) Farouz F., Miller M. J., Tetrahedron Lett. , 32,3305 (1991).
42 a) Miller M. J., Mattingly P. G., Morrison M. A., Kerwin J. F. Jr., J. Am. Chem. Soc., 102 , 7026 (1980). b) Bose A. K., Sahu D. P.,Manhas M. S., J. Org. Chem. , 46, 1229 (1981). c) Krook M. A., Miller M. J., J. Org. Chem. , 50, 1126 (1985). d) Galéotti N.,Montagne C., Poncet J., Jouin P., Tetrahedron Lett. , 33, 2807 (1992). e) Koppel I., Koppel J., Koppel I., Leito I., Pihl V., Wallin A.,Grehn L., Ragnarsson U., J. Chem. Soc., Perkin Trans. 2 , 655 (1993).
43 a) Houghton R. P., Williams C. S., Tetrahedron Lett. , 8 , 3929 (1967). b) Levin J. I., Turos E., Weinreb S. M., Synth. Commun., 12,989 (1982). c) Lesimple P., Bigg D. C. H., Synthesis, 306 (1991).
44 For L-RNA (a) Ashley, G. W., J. Am. Chem. Soc. , 114 , 9731 (1992). For L-DNA (b) Damha, M. J.; Giannaris, P. A.; Marfey, P.,Biochemistry , 33, 7877 (1994). (c) Hashimoto, Y.; Iwanami, N.; Fujimori, S.; Shudo, K., J. Am. Chem. Soc., 115 , 9883 (1993). (d)Fujimori, S.; Shudo, K.; Hashimoto, Y., J. Am. Chem. Soc. , 112 , 7436 (1990).
45 a) W. D. Ollis, C. Smith, D. E. Wright, Tetrahedron, 35, 105 (1979); b) D. E. Wright, Tetrahedron, 35, 1207 (1979).
46 a) H. Ohtake, T. Iimori, S. Ikegami, Tetrahedron Lett. , 38, 3413 (1997); b) H. Ohtake, T. Iimori, M. Shiro, S. Ikegami, Heterocycles ,
47, 685 (1998); c) H. Ohtake, N. Ichiba, M. Shiro, S. Ikegami, J. Org. Chem., 65, 8164 (2000).47 M. Kurihara, N. Miyata, Chem. Lett., 1995, 263.
48 a) H. Ohtake, T. Iimori, S. Ikegami, Tetrahedron Lett. , 38, 3413 (1997); b) H. Ohtake, T. Iimori, M. Shiro, S. Ikegami, Heterocycles ,47, 685 (1998); c) H. Ohtake, N. Ichiba, M. Shiro, S. Ikegami, J. Org. Chem., 65, 8164 (2000).
49 F. Mohamadi, N. G. J. Richards, W. C. Guida, R. Liskamp, M. Lipton, C. Caufield, G. Chang, T. Hendricson, W. C. Still, J. Comput.Chem. , 11, 440 (1990).
50 a) I. Kolossváry, W. C. Guida, J. Am. Chem. Soc., 118 , 5011 (1996); b) G. Cheng, W. C. Guida, W. C. Still, J. Am. Chem. Soc., 111 ,4379 (1989).
51 T. Yoshimura, Yuki Gosei Kagaku Kyokaishi (J. Synth. Org. Chem. Jpn.), 42, 514 (1984).
52 a) R. U. Lemieux, “Molecular Rearrangements”, ed. by P. De Mayo, Interscience, New York, 1964; b) A. J. Kirby, “The AnomericEffect and Related Stereoelectronic Effects at Oxygen”, Springer Verlag, Berlin, 1983; c) I. Tvaroska, T. Bleha, “Advances inCarbohydrate Chemistry and Biochemistry”, Vol. 47, eds. by R. S. Tipson, D. Horton, Academic Press, San Diego, 1989, p. 45.
53 a) K. Pihlaja, J. Heokkli*, Acta Chem. Scand. , 21, 2390 (1967); b) E. L. Eliel, F. W. Nader, J. Am. Chem. Soc., 92, 584 (1970); c)U. Salzner, P. v. R. Schleyer, J. Org. Chem., 59, 2138 (1994).
54 a) T. Iimori, H. Ohtake, S. Ikegami, Tetrahedron Lett. , 38, 3415 (1997); b) H. Ohtake, T. Iimori, S. Ikegami, Synlett, 1998, 1420; c)H. Ohtake, N. Ichiba, S. Ikegami, J. Org. Chem., 65, 8171 (2000).
55 a) K. Toshima, K. Tatsuta, Chem. Rev., 93, 1503 (1993); b) G. -J. Boons, Tetrahedron, 52, 1095 (1996); c) S. J. Danishefsky, M.T. Bilodeau, Angew. Chem., Int. Ed. Engl., 35, 1380 (1996); d) S. Hashimoto, Y. Honda, Y. Yanagitani, M. Nakajima, S. Ikegami,Yuki Gosei Kagaku Kyokaishi (J. Synth. Org. Chem. Jpn.), 53, 620 (1995).
56 a) S. S. Bhattacharjee, P. A. J. Gorin, <st1:country-region w:st="on">Can. J. Chem., 47, 1195 (1969); b) A. Lipták, I. Jodál, P. Nánási, Carbohydr. Res., 44, 1(1975).
57 a) P. J. Garegg, H. Hultberg, S. Wallin, Carbohydr. Res., 108 , 97 (1982); b) R. Johansson, B. Samuelsson, J. Chem. Soc., PerkinTrans. 1 , 1984, 2371.
58 P. Deslongchamps, R. Chénevert, R. J. Taillefer, C. Moreau, J. K. Saunders, Can. J. Chem., 53, 1601 (1975).
59 Other step-wise b-mannosylation methods: a) A. Dan, A. Y. Ito, T. Ogawa, Tetrahedron Lett. , 36, 7487 (1995). idem., J. Org.Chem., 60, 4680 (1995); b) F. Barresi, O. Hindsgaul, <st1:country-region w:st="on">Can. J. Chem., 72, 1447 (1994); c) G. Stork, J. J. La Clair, J. Am. Chem.Soc., 118 , 247 (1996); d) F. W. Lichtenthaler, T. Schneider-Adams, S. Immel, J. Org. Chem., 59, 6735 (1994).
60 N. Hada, I. Ohtsuka, M. Sugita, T. Takeda, Tetrahedron Lett. , 41, 9065 (2000).
61 a) H. Ohtake, S. Ikegami, Org. Lett., 2, 457 (2000); b) H. Ohtake, X. L. Li, M. Shiro, S. Ikegami, Tetrahedron, 56, 7109 (2000).
62 Y. Naruse, H. Yamamoto, Tetrahedron Lett. , 27, 1363 (1986).
63 Mukaiyama, T.; Banno, K.; Narasaka, K., J. Am. Chem. Soc., 96, 7503 (1974).
64 Kobayashi, S.; Nagayama, S.; Busujima, T., J. Am. Chem. Soc., 120 , 8287 (1998).
65 H. Fukase, S. Horii, J. Org. Chem., 57, 3642 (1992).
66 a) Y. Kameda, M. Asano, M. Yoshikawa, M. Takeuchi, T. Yamaguchi, K. Matsui, S. Horii, H. Fukase, J. Antibiot. , 37, 1301 (1984);b) S. Horii, H. Fukase, Y. Kameda, Carbohydr. Res., 140 , 185 (1985).
67 a) H. Paulsen, F. R. Heiker, Liebigs Ann. Chem. , 1981, 2180; b) N. Sakairi, H. Kuzuhara, Tetrahedron Lett. , 23, 5327 (1982); c) S.Ogawa, N. Chida, T. Suami, J. Org. Chem., 48, 1203 (1983); d) R. R. Schmidt, A. Köhn, Angew. Chem., Int. Ed. Engl., 26, 482(1987); e) M. Yoshikawa, B. C. Cha, T. Nakae, I. Kitagawa, Chem. Pharm. Bull., 36, 3714 (1988); f) F. Nicotra, L. Panza, F.Ronchetti, G. Russo, Gazz. Chim. Ital., 11 9 , 577 (1989); g) T. K. Park, S. J. Danishefsky, Tetrahedron Lett. , 35, 2667 (1994); h) T.K. M. Shing, L. H. Wan, L. H., J. Org. Chem., 61, 8468 (1996); i) B. M. Trost, L. S. Chupak, T. Lübbers, J. Am. Chem. Soc., 120 ,1732 (1998); j) S. Ogawa, C. Uchida, T. Ohhira, Carbohydr. Lett., 3 , 277, (1999).
68 O.22) Fukase, Yuki Gosei Kagaku Kyokaishi (J. Synth. Org. Chem. Jpn.), 55, 920 (1997); b) H. Fukase, S. Horii, J. Org. Chem.,57, 3642 (1992); c) H. Fukase, S. Horii, J. Org. Chem., 57, 3651 (1992); d) S. Horii, H. Fukase, T. Matsuo, Y. Kameda, N. Asano,K. Matsui, J. Med. Chem. , 29, 1038 (1986).
注:本文为提供者整理翻译的,由于知识所限,错误在所难免,敬请原谅。如有问题可以查找原文。



 沪公网安备 31010602001115号
沪公网安备 31010602001115号