| 物竞编号 | 094V |
|---|---|
| 分子式 | MnO2 |
| 分子量 | 86.93 |
| 标签 | 黑色氧化锰, Manganese binoxide, Manganese dioxide, Manganese peroxide, Manganese superoxide, Black manganese oxide, 氧化剂, 催化剂, 干燥剂 |
编号系统
CAS号:1313-13-9
MDL号:MFCD00003463
EINECS号:215-202-6
RTECS号:OP0350000
BRN号:暂无
PubChem号:24877699
物性数据
1.性状:深棕色粉末
2.熔点(分解,oC):mp 535
3.密度:5.03 g/cm3
4.溶解性:不溶于水和有机溶剂。
毒理学数据
1、急性毒性:大鼠口经LD50:>3478mg/kg,小鼠植入皮下LC50:422mg/kg。氧化锰粉尘可引起人的锰尘肺。高价锰氧化物,不论侵入机体的途径,其毒性作用对大脑有损伤。
生态学数据
对是水稍微有危害的不要让未稀释或大量的产品接触地下水、水道或者污水系统,若无政府许可,勿将材料排入周围环境。
分子结构数据
1、摩尔折射率:无可用的
2、摩尔体积(cm3/mol):无可用的
3、等张比容(90.2K):无可用的
4、表面张力(dyne/cm):无可用的
5、介电常数:无可用的
6、极化率(10-24cm3):无可用的
7、单一同位素质量:86.927878 Da
8、标称质量:87 Da
9、平均质量:86.9368 Da
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:2
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积34.1
7.重原子数量:3
8.表面电荷:0
9.复杂度:18.3
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
1.如果遵照规格使用和储存则不会分解,未有已知危险反应,避免还原剂、易氧化材料、酸、铝和铝合金、卤间化合物.有强氧化性。
2.与冷盐酸反应生成高价氯化锰的棕色溶液,经受热放出氯气并形成氯化锰。在氢气中加热至200 ℃左右,生成三氧化二锰及四氧化三锰。在热浓硫酸中放出氧而成硫酸锰。与苛性钠和氧化剂共熔生成锰酸盐。与硫黄加热时,形成二氧化硫及硫化锰。在高温下遇碳还原成金属锰。420℃时遇一氧化碳还原为一氧化锰。遇双氧水或氯酸钾发生催化分解。加热到535 ℃分解脱氧,生成低价锰的氧化物。
贮存方法
保持贮藏器密封、储存在阴凉、干燥的地方,确保工作间有良好的通风或排气装置。
合成方法
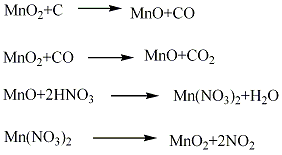
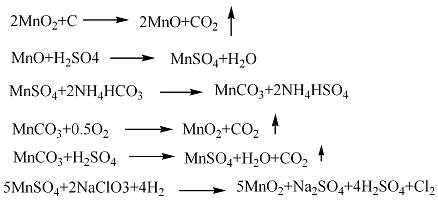
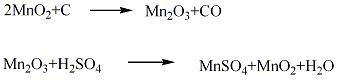
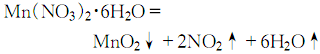
用途
1.主要用在干电池中作去极化剂。是玻璃工业中的良好脱色剂,可将低价铁盐氧化成高铁盐,使玻璃的蓝绿色转为弱黄色。
2.电子工业中用以制锰锌铁氧体磁性材料。炼钢工业中用作铁锰合金的原料,浇铸工业的增热剂。防毒面具中用作一氧化碳的吸收剂。
3.化学工业中用作氧化剂(如紫红素合成)、有机合成的催化剂、油漆和油墨的干燥剂。也用作火柴工业的助燃剂,陶瓷、搪瓷的釉药和锰盐的原料。还用于烟火,水的净化除铁、医药、肥料及织物印染等方面。
4.在有机合成中,MnO2被用作氧化剂,其反应活性与其结构、制备方法以及溶剂极性有关[1]。
不饱和脂肪醇的氧化 用MnO2能将烯丙基醇转化为α,β-乙烯基醛,当醇或胺存在时,酰基氰化物会醇解或氨解得到相应的α,β-乙烯基酯和氨。炔丙基醇可以被MnO2氧化成烷基醛和酮,而不稳定的炔丙基醛能进一步得到Michael产物 (式1)[2]。
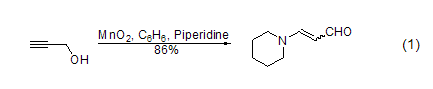
苯基醇和杂环醇的氧化 共轭芳醛或酮可以由MnO2氧化芳基醇得到,而同时很多其它的官能团却不会参与反应 (式2)[3]。
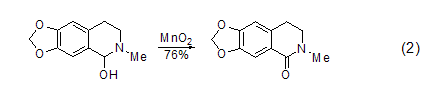
饱和醇的氧化 饱和的脂肪醇和脂肪环醇与MnO2反应可以高产率得到饱和的醛或酮 (式3)[4]。1,2-二醇很容易被MnO2氧化为醛或酮,而1,2-环二醇则反应生成二醛或者是二酮,这在很大程度上决定于反应物的结构。
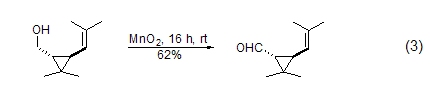
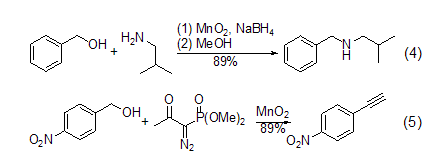
胺与炔的合成 在硼氢化钠存在下,α,β-不饱和烯醇氧化后可以与胺进一步反应 (式4)[5]。一级醇在MnO2氧化后用Bestmann-Ohira试剂处理可以得到端炔 (式5)[6]。
氰基转化为酰胺 在硅胶的参与下,MnO2能把氰基转化为酰胺 (式6)[7]。
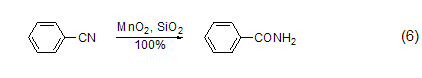
胺类化合物的氧化 用MnO2氧化胺可以得到甲酰胺、重氮化合物等。二烷基羟胺用MnO2氧化会得到相应的硝酮 (式7)[8]。

其它反应 MnO2也可以用来发生其它反应,如α-羟基酸的裂解、二芳基甲烷的氧化、二芳基酮的转化、醛到羧酸的转化、由硫制备二硫化物、由磷制备磷化物或是由胺制备酮。此外,近两年兴起的在二氧化锰中添加高锰酸钾的绿色循环方法也有了广泛应用 (式8,式9)[9]。
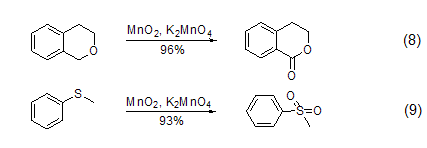
安全信息
危险运输编码:UN 3137
危险品标志: 有害
有害
安全标识:S25
危险标识:R20/22
文献
1. Hudlicky, M. Oxidations in Organic Chemistry, American Chemical Society: Washington, 1990. 2. Makin, S. M.; Ismail, A. A.; Yastrebov, V. V.; Petrv, K. I. Zh. Org. Khim., 1971, 7, 21210 (CA 1972, 76, 13712). 3. Hansel, R.; Su, T. L.; Schulz, J. Chem. Ber., 1977, 110, 3664. 4. Crombie, L.; Crossley, J. J. Chem. Soc., 1963, 4983. 5. Kanno, H.; Taylor, R. J. K. Tetrahedron Lett., 2002, 43, 7337. 6. Quesada, E.; Taylor, R. J. K. Tetrahedron Lett., 2005, 46, 6473. 7. Liu, K. T.; Shin, M. H.; Huang, H. W.; Hu, C. J. Synthesis, 1988, 715. 8. Cicchi, S.; Marradi, M.; Goti, A.; Brandi, A. Tetrahedron Lett., 2001, 42, 6503. 9. Shaabani, A.; Mirzaei, P.; Naderia, S.; Lee, D. G. Tetrahedron, 2004, 60, 11415. 10.参考书:现代有机合成试剂<性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无




 沪公网安备 31010602001115号
沪公网安备 31010602001115号