| 物竞编号 | 02EJ |
|---|---|
| 分子式 | C6H7BO2 |
| 分子量 | 121.93 |
| 标签 | Phenylboronic Acid, Phenyboric Acid, Benzeneboroic Acid, 医药中间体 |
编号系统
CAS号:98-80-6
MDL号:MFCD00002103
EINECS号:202-701-9
RTECS号:CY8575000
BRN号:970972
PubChem号:24887271
物性数据
1. 性状:白色晶体
2. 密度(g/mL,25℃):未确定
3. 相对蒸汽密度(g/mL,空气=1):未确定
4. 熔点(ºC):217
5. 沸点(ºC,常压):未确定
6. 沸点(ºC, 14mmHg):未确定
7. 折射率:未确定
8. 闪点(ºC):未确定
9. 比旋光度(º):未确定
10. 自燃点或引燃温度(ºC): 未确定
11. 蒸气压(mmHg, 40ºC):未确定
12. 饱和蒸气压(kPa, ºC):未确定
13. 燃烧热(KJ/mol):未确定
14. 临界温度(ºC):未确定
15. 临界压力(KPa):未确定
16. 油水(辛醇/水)分配系数的对数值:未确定
17. 爆炸上限(%,V/V):未确定
18. 爆炸下限(%,V/V):未确定
19. 溶解性:在水和苯等溶剂中溶解度不大,易溶于乙醚和甲醇。
毒理学数据
生态学数据
该物质对水有稍微的危害。
分子结构数据
1、 摩尔折射率:33.28
2、 摩尔体积(cm3/mol):107.0
3、 等张比容(90.2K):271.7
4、 表面张力(dyne/cm):41.4
5、 介电常数:
6、 偶极距(10-24cm3):
7、 极化率:13.19
计算化学数据
1、 疏水参数计算参考值(XlogP):
2、 氢键供体数量:2
3、 氢键受体数量:2
4、 可旋转化学键数量:1
5、 互变异构体数量:
6、 拓扑分子极性表面积(TPSA):40.5
7、 重原子数量:9
8、 表面电荷:0
9、 复杂度:79.1
10、同位素原子数量:0
11、确定原子立构中心数量:0
12、不确定原子立构中心数量:0
13、确定化学键立构中心数量:0
14、不确定化学键立构中心数量:0
15、共价键单元数量:1
性质与稳定性
1.避免与强氧化剂接触。
2.该试剂暴露在空气中或者在加热条件下容易脱水,形成三分子的聚合物。
贮存方法
1.储存于阴凉、干燥、通风良好的库房。远离火种、热源。包装必须密封,切勿受潮。应与氧化剂分开存放,切忌混储。配备相应品种和数量的消防器材。储区应备有合适的材料收容泄漏物。
合成方法
1. 在1小时内,将0.25摩尔苯基溴化镁(大约1摩尔溶液)加到58克(0.25摩尔)硼酸正丁酯溶于100毫升纯乙醚的溶液中。反应期间溶液用机械搅拌和固体二氧化碳和丙酮浴冷却,使内部温度保持在一70℃至一75℃之间。当格氏试剂滴进反应液时,立即形成白色沉淀,沉淀慢慢又溶解。格氏试剂加完后,继续搅拌反应混合物(在一75℃)至沉淀全部溶解。生成的桔黄色溶液在冷水浴中慢慢升温至0℃(最好过夜)。在剧烈搅拌下,将反应混合物慢侵加到150毫升冷的10%硫酸中,分出乙醚层。水层用2份100毫升乙醚萃取。合并原来的乙醚层和乙醚萃取液,在蒸汽浴上蒸去乙醚。残留液中含苯基硼酸和正丁醇,用氢氧化钾溶液处理,至溶液明显呈碱性。加入足够的水,使得在醇层下面形成约150毫升的水层。在减压下温和加热<不超过45℃),水汽蒸馏蒸出正丁醇,按需要经常慢慢加些温热水,继续蒸馏至无正丁醇馏出为止。最后有少量联苯被蒸出,而蒸馏瓶中的水层则分离出少量粘性固体。
残留液中加入硫酸酸化,至刚果红试纸变色,稀释(如果需要)至150一200毫升。不用分出沉淀,在继续搅拌下将混合物加热至沸腾,短时间后晶体完全融化,成为重的不溶的棕色油层。倾出水层,使之经过折叠滤纸。油层用几份20毫升沸水提取,趁热过滤提取液,与原来的水层合并,冷却后结晶出白色针状的苯基硼酸。产品干燥后重14一17克(50-60%),不再精制,用毛细管测得熔点 214一216℃(校正)。从母液中还可回收1一2克不纯的产品。当大量制备时用更浓的格氏试剂溶液,产率则要低点(42-47%)。
用相似的方法可以制得对甲苯基硼酸、对甲氧基硼酸等。
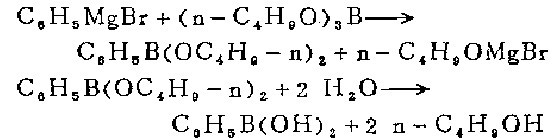
2.实验室可以通过苯基格氏试剂和硼酸三酯反应来制备。
用途
苯基硼酸是一种化学实验室常备的化学试剂。它很容易和二醇或者二胺等化合物形成环状的硼酸酯 (式1)。X = Y = O时,形成酯的能力是n = 3 >2 > 4。顺式的环状二醇能够与苯基硼酸形成1:1的硼酸酯,而反式的环状二醇则形成1:2的多聚酯。此性质可以用于cis- 和trans- 二醇的分离 (式2)[1]。
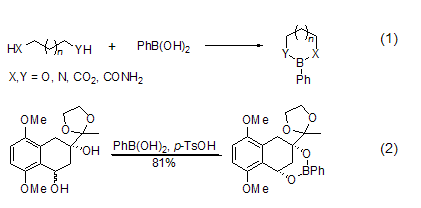
苯基硼酸很容易和二醇或者二胺发生反应,而且极易离去。所以,它们常常被用作二醇或二胺类化合物的保护基[2]。该保护基在羟基的酯化、甲基化和硅醚化等反应中都比较稳定。
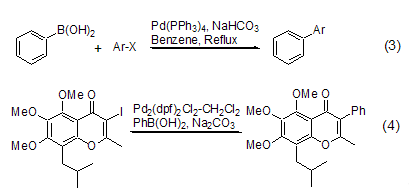
苯基硼酸参与的一个重要反应是Suzuki反应。在碱性条件和Pd配合物的催化下,苯基硼酸可以与Vinyl-X (X = Br, OTf)[3],Ar-X (X = Cl[4], Br, I, OTf) 发生偶联反应 (式3)。作为芳基化的重要方法,Suzuki反应在一些天然产物的全合成中得到了广泛的应用 (式4)[5]。苯基硼酸也常常用作一种标准的反应物来说明不同催化剂在Suzuki反应中的优劣。
在Cu(OAc)2的催化下,苯基硼酸能够发生C-N键或C-O键的生成反应 (式5)[6,7],得到芳香胺、N-芳基取代杂环化合物 (式6)[8]或者二芳基醚等。使用弱碱在室温下就能使该反应顺利进行,这对经典的Ulmmann芳基化反应和Goldberg反应是一个显著的改进。

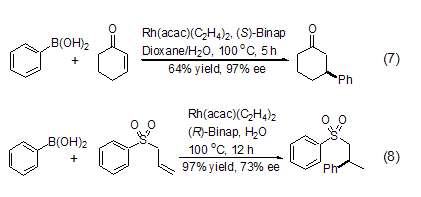
在金属Rh和手性磷配体的催化下,有机硼酸可以和α,β-不饱和羰基化合物发生1,4-不对称加成反应。同有机金属化合物相比,有机硼酸不仅反应条件更加温和,而且具有更高的区域选择性和对映体选择性 (式7,式8)[9,10]。
安全信息
危险运输编码:暂无
危险品标志: 有害
有害  刺激
刺激  危害环境
危害环境
危险标识:R22
文献
1. Broadhurst, M. J.; Hassall, C. H.; Thomas, G. J. J. Chem. Soc., 1982, 2239. 2. Yurkevich, A. M.; Kolodkina, I. I.; Varshavskaya, L. S. Tetrahedron, 1969, 25, 477. Yasuda, N.; Xavier, L.; Rieger, D. L.; Li, Y.; DeCamp, A. E.; Dolling, U. H. Tetrahedron Lett., 1993, 34, 3211. 4. Navarro, O.; Kelly, R. A.; Nolan, S. P. J. Am. Chem. Soc., 2003, 120, 16194. 5. Ding, K.; Wang, S. Tetrahedron Lett., 2005, 46, 3707. 6. Evans, D. A.; Katz, J. L.; West, T. R. Tetrahedron Lett., 1998, 39, 2937. 7. Chiang, C. H.; Thomas, O. Org. Lett., 2004, 6, 3079. 8. Berkel, S. S.; Hoogenband, A.; Terpstra, J. W. Tetrahedron Lett., 2004, 45, 7659. 9. Takaya, Y.; Ogasawara, M.; Hayashi, T. J. Am. Chem. Soc., 1998, 120, 5579. 10. Mauleo´n, P.; Carretero, J. C. Org. Lett., 2004, 6, 3195. 11.参考书:现代有机合成试剂<性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无



 沪公网安备 31010602001115号
沪公网安备 31010602001115号