| 物竞编号 | 057P |
|---|---|
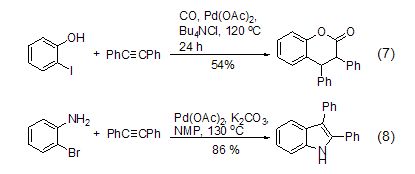
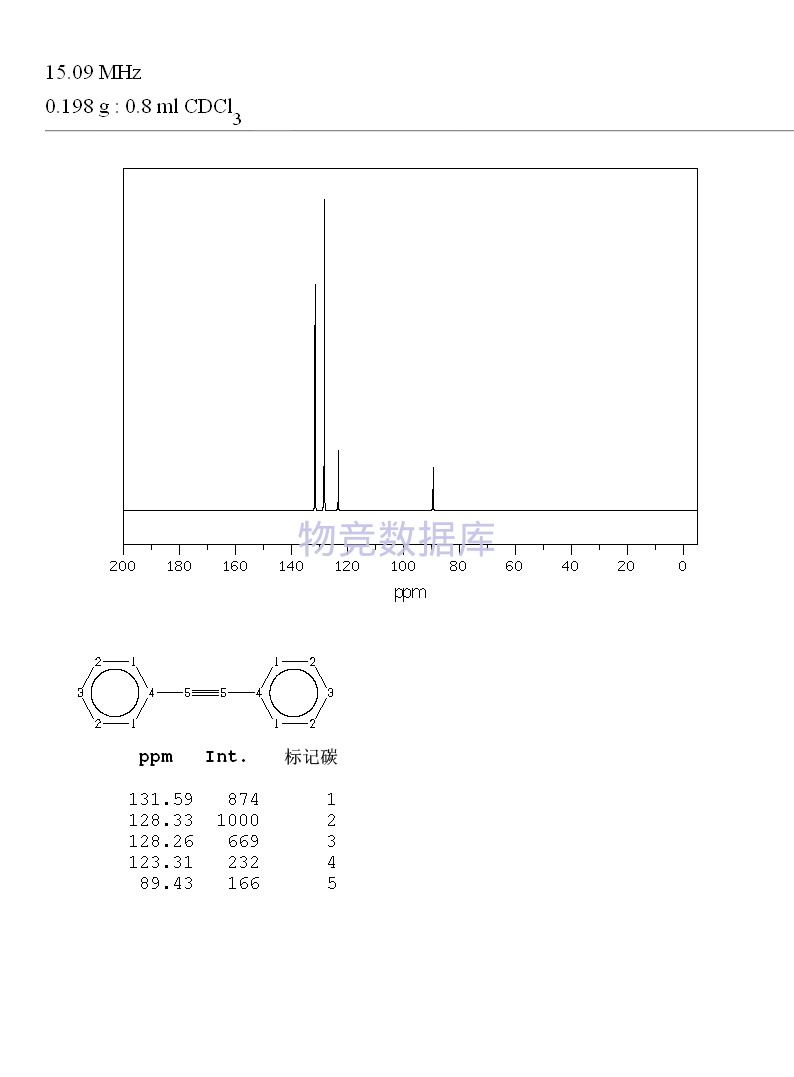
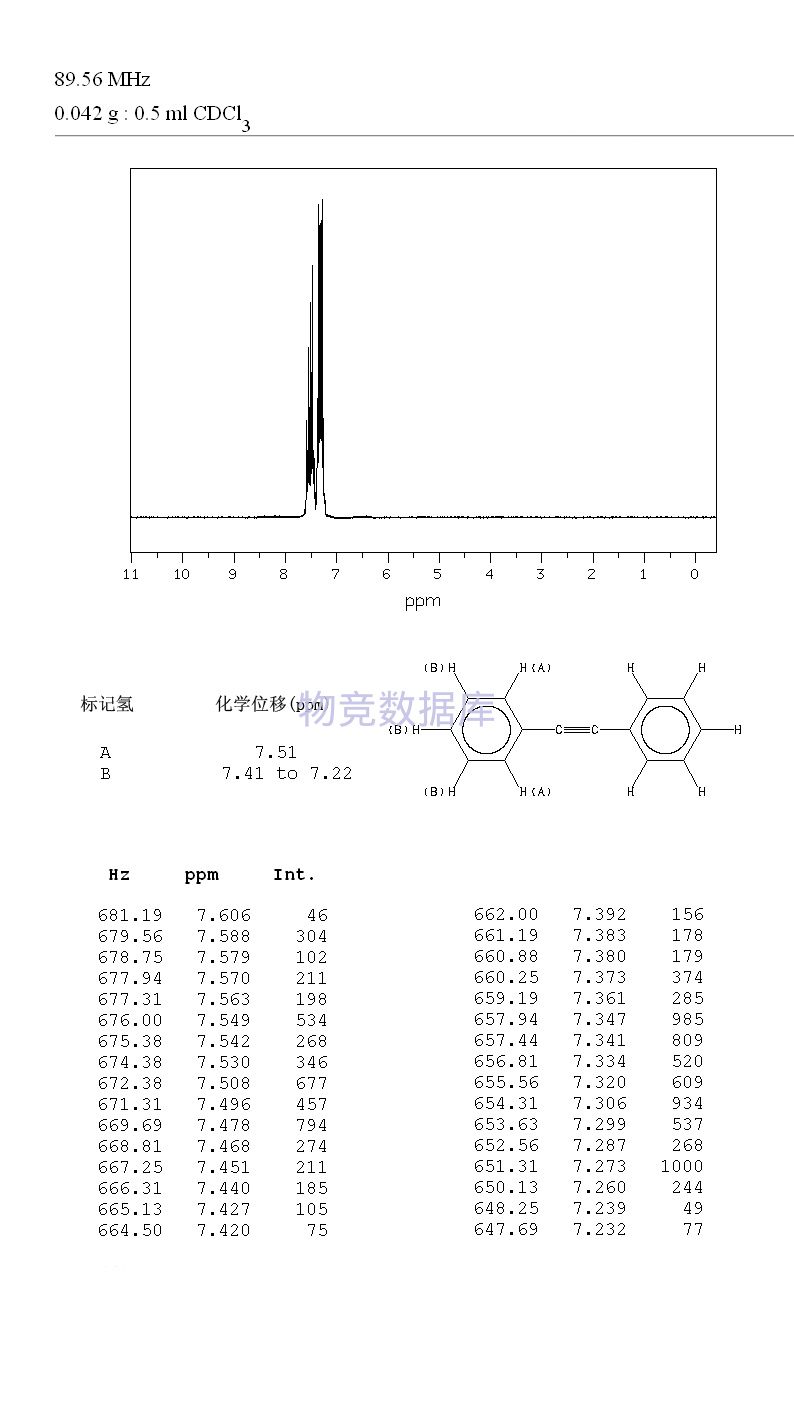
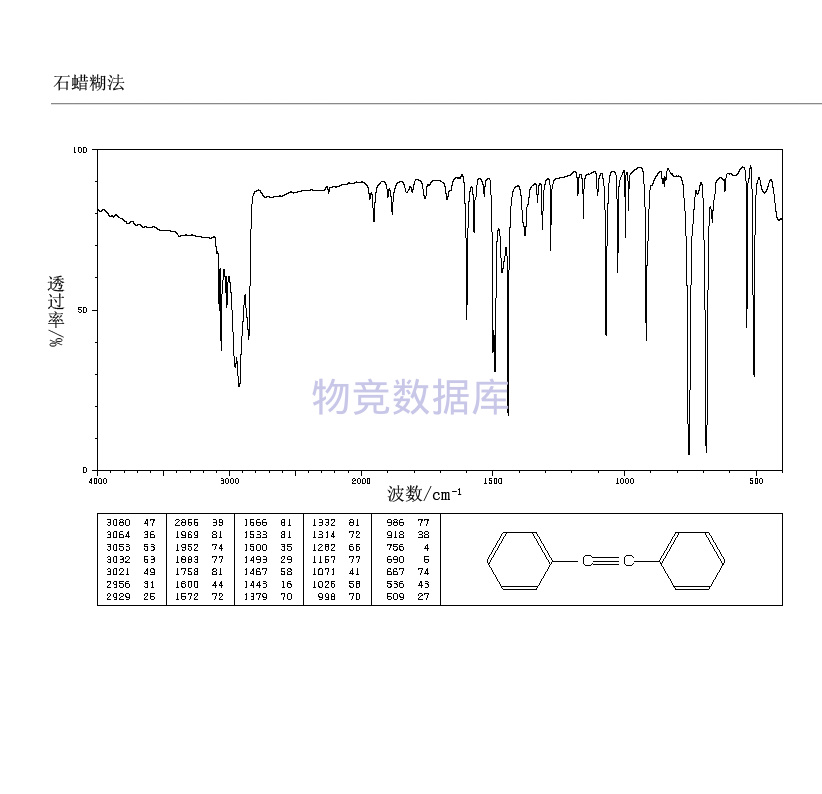
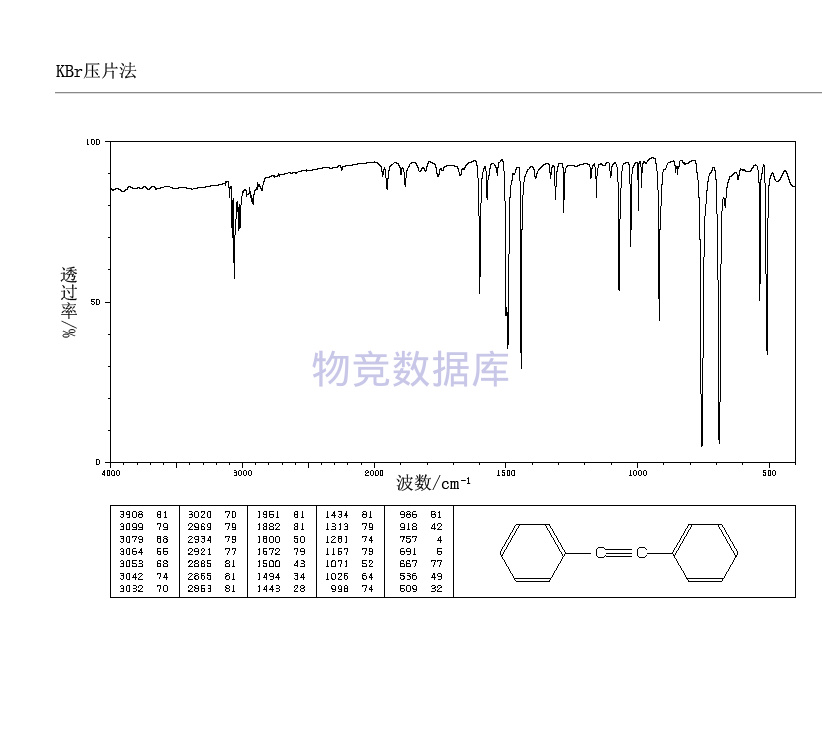
| 分子式 | C14H10 |
| 分子量 | 178.23 |
| 标签 | 二苯基乙炔, 二苯乙炔 |
编号系统
CAS号:501-65-5
MDL号:MFCD00004786
EINECS号:207-926-6
RTECS号:暂无
BRN号:606478
PubChem号:24866731
物性数据
1. 性状:无色固体
2. 密度:0.990 g/cm3
3. 晶相标准热熔(J·mol-1·K-1):226
4. 熔点(ºC):62.5
5. 沸点(ºC,0.3 mmHg):90~97
6. 晶相相标准燃烧热(焓)(kJ·mol-1):-7250.7
7. 晶相标准声称热(焓)( kJ·mol-1):312.4
8. 闪点(ºC):170
9. 比旋光度(º):未确定
10. 自燃点或引燃温度(ºC):未确定
11. 蒸气压(kPa,25ºC):未确定
12. 饱和蒸气压(kPa,60ºC):未确定
13. 燃烧热(KJ/mol):未确定
14. 临界温度(ºC):未确定
15. 临界压力(KPa):未确定
16. 油水(辛醇/水)分配系数的对数值:未确定
17. 爆炸上限(%,V/V):未确定
18. 爆炸下限(%,V/V):未确定
19. 溶解性:溶于乙醚、热的乙醇。
毒理学数据
生态学数据
该物质对环境可能有危害,对水体应给予特别注意。
分子结构数据
1、 摩尔折射率:58.73
2、 摩尔体积(cm3/mol):166.6
3、 等张比容(90.2K):434.8
4、 表面张力(dyne/cm):46.3
5、 极化率(10-24cm3):23.28
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:0
4.可旋转化学键数量:2
5.互变异构体数量:无
6.拓扑分子极性表面积0
7.重原子数量:14
8.表面电荷:0
9.复杂度:193
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
1.按规格使用和贮存,不会发生分解,避免与氧化物接触。
2.低毒,可通过皮肤吸收。
贮存方法
密封保存,放置在通风,干燥的环境中。
合成方法
1.制法:

苯偶酰腙(3):于装有搅拌器、回流冷凝器的反应瓶中,加入二苯乙二酮(2)105.1g(0.5mol),正丙醇325mL,85%的水合肼76g(1.3mol),加热回流60h。冷后抽滤,用冷的无水乙醇洗涤,干燥,得苯偶酰腙(3)99~106g,mp150~151.5℃,收率83%~89%。二苯乙炔(1):于装有搅拌器、回流冷凝器的反应瓶中,加入上述化合物(3),480mL苯,搅拌下加入黄色氧化汞2~4g,微微加热,有氮气放出,反应物变灰色。加热至微沸,不断加入氧化汞2~4g,总共加入氧化汞240g(1.1mol)。加完后继续搅拌1h。放置过夜。抽滤,滤饼用100mL苯洗涤。合并苯溶液,水洗,无水硫酸钠干燥,减压回收苯后高真空蒸馏,收集95~105℃/27~40Pa的馏分,得二苯乙炔①(1)60~65g,收率67%~73%。产品可用100mL(95%)的乙醇重结晶提纯。注:①利用类似方法可以制备二对甲苯基乙炔(C16H14)、a-萘基苯基乙炔(C18H12)。[1]
用途
二苯乙炔是取代茋和偶苯酰的合成前体[1],可以进行环加成反应。由于对称性和高度的平面性,二苯乙炔是非常好的Lewis酸,在金属有机化学中也是很好的配体。
氧化及还原 二苯乙炔可以被钼(VI)和钨(VI)的多氧金属、[二(三氟乙酸)碘代]五氟苯氧化生成安息香酸。铬族络合物、锌-铬、锰酸钡以及其它试剂可使二苯乙炔氧化成偶苯酰[2]。
二苯乙炔的有效还原方法如下:可用NiCl2·4PPh3酸制备反式茋,在钌催化剂作用下发生氢化反应生成顺式茋,也可用CoCl2·4PPh3、SmI2、AcOH或用锌与Pd/C结合来完成[3],利用氢和蒙脱石-(二苯基膦化氢)钯(II)络合物或用锌与Pd/C结合可将炔键还原成烷烃。
炔烃π键与X-Y的加成 很多试剂可对炔键加成。例如,RS-Cl (式1)[4]、PhSe-F、Me3Sn-PPh2、PhS-F、PhS-SPh和ClHg-OAc可与二苯乙炔发生反式加成,而Bu3Sn-H (式2)[5]、RNH-H和HO2C-H则会生成顺式芪衍生物。H-CN、TMS-CN、X2 (X=卤素)、Et-AlEt2等也可与二苯乙炔加成。
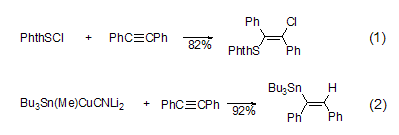
卡宾加成 二苯乙炔可与铬、钨和卡宾钴等发生加成反应。Fischer类型卡宾铬与二苯乙炔反应生成环戊酮。而卡宾铬中含氮时可以得到吡咯啉酮 (式3)[6]。Fischer类型的卡宾钨可直接反应,因为可以形成七元环 (式4)[7]。
与不同金属的相互作用 二苯乙炔可用于钯催化偶合反应和环化反应中 (式5)[8],而镍则可以形成螺环化合物 (式6)[9],锌络合物的插入则可生成许多不饱和分子。二苯乙炔有和有机金属络合物及有机金属簇结合的倾向,并能进行金属化反应。

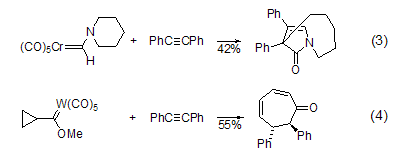
环的形成及环加成 二苯乙炔可通过环加成反应来制备酯(式7)[10]、唑、苯并噻吩、吲哚(式8)[11]、吡咯和呋喃-2(5H)-酮等化合物及其衍生物。
安全信息
危险运输编码:暂无
危险品标志:暂无
安全标识:暂无
危险标识:暂无
文献
[1]参考文献:1、Cope A C,Smith D S,Cotter R J.Org Synth,1963,Coll Vol 4:377. 2、林原斌,刘展鹏,陈红飙.有机中间体的制备与合成.北京:科学出版社,2006:108. 参考书:有机化合物合成手册/孙昌俊,王秀菊,孙风云主编. 北京:化学工业出版社,2011.8 ISBN 978-122-11519-53. Shosenji, H.; Nakano, Y.; Yamada, K. Chem. Lett., 1988, 1033. 4. Capozzi, G.; Gori, L.; Menichetti, S.; Nativi, C. J. Chem. Soc., Perkin Trans.1, 1992, 1923. 5. Barbero, A.; Cuadrado, P.; Fleming, I.; Gonzalez, A.; Pulido, F. Chem. Commun., 1992, 351. 6. Parlier, A.; Rudler, H.; Yefsah, R.; Alvarez, C. J. Organomet. Chem., 1987, 328, C21. 7. Herndon, J.; Chatterjee, G.; Patel, P.; Matasi, J.; Tumer, S.; Harp, J.; Reid, M. J. Am. Chem. Soc., 1991, 113, 7808. 8. (a) Silverberg, L.; Wu, G.; Rheingold, A.; Heck, R. J. Organomet. Chem., 1991, 409, 411. (b) Wu, G.; Rheingold, A.; Geib, S.; Heck, R. Organometallics, 1987, 6, 1941. 9. Kong, K.; Cheng, C. Organometallics, 1992, 11, 1972. 10. Dmitry, V. K.; Richard, C. L. J. Org. Chem., 2003, 68, 9423. 11. Shen, M.; Li, G. S.; Lu, B. Z.; Hossain, A.; Roschangar, F.; Farina, V.; Senanayake, C. H. Org. Lett., 2004, 6, 4129. 12.参考书:现代有机合成试剂<性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无





 沪公网安备 31010602001115号
沪公网安备 31010602001115号