| 物竞编号 | 05MT |
|---|---|
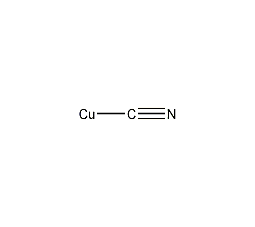
| 分子式 | CuCN |
| 分子量 | 89.56 |
| 标签 | 氰化铜(Ⅰ), 氰化铜, Copper monochloride, Cuprous chloride, 电镀化学品, 络合剂, 印刷线路板电镀用原材料 |
编号系统
CAS号:544-92-3
MDL号:MFCD00010975
EINECS号:208-883-6
RTECS号:GL7150000
BRN号:暂无
PubChem号:暂无
物性数据
1.性状:白色单斜结晶粉末或淡绿色粉末[5]
2.熔点(℃):475[6]
3.沸点(℃):分解[7]
4.相对密度(水=1):2.9(氮气中)[8]
5.辛醇/水分配系数:-1.49[9]
6.溶解性:不溶于水、醇类、稀酸,易溶于浓盐酸,溶于液氨。[10]
毒理学数据
1、急性毒性:大鼠经口LD50:1265mg/kg,除致死剂量外无详细说明;慢性中毒会出现头痛、消瘦,最高容许浓度为0.5mg·m-3。
生态学数据
1.生态毒性 暂无资料
2.生物降解性 暂无资料
3.非生物降解性 暂无资料
4.其他有害作用[11] 该物质对环境有危害,应特别注意对水体的污染。
分子结构数据
1、摩尔折射率:无可用的
2、摩尔体积(cm3/mol):无可用的
3、等张比容(90.2K):无可用的
4、表面张力(dyne/cm):无可用的
5、介电常数:无可用的
6、极化率(10-24cm3):无可用的
7、单一同位素质量:88.932675 Da
8、标称质量:89 Da
9、平均质量:89.5634 Da
计算化学数据
1、疏水参数计算参考值(XlogP):无
2、氢键供体数量:0
3、氢键受体数量:2
4、可旋转化学键数量:0
5、互变异构体数量:无
6、拓扑分子极性表面积(TPSA):23.8
7、重原子数量:3
8、表面电荷:0
9、复杂度:10
10、同位素原子数量:0
11、确定原子立构中心数量:0
12、不确定原子立构中心数量:0
13、确定化学键立构中心数量:0
14、不确定化学键立构中心数量:0
15、共价键单元数量:2
性质与稳定性
1.不溶于水和冷的稀酸,易溶于氨水、铵盐溶液和浓盐酸,在沸腾的稀盐酸中分解成氯化亚铜和氰化氢。溶于氰化钠、氰化铵、氰化钾时生成氰铜络合物。可与多种金属离子形成络合物。温度高于130℃时自燃。与氯酸盐或亚硝酸钠混合能引起爆炸。剧毒!
2.稳定性[12] 稳定
3.禁配物[13] 强氧化剂、酸类
4.避免接触的条件[14] 潮湿空气、受热
5.聚合危害[15] 不聚合
贮存方法
储存注意事项[16] 储存于阴凉、通风的库房。远离火种、热源。库内相对湿度不超过80%。包装密封。应与氧化剂、酸类、食用化学品分开存放,切忌混储。储区应备有合适的材料收容泄漏物。
合成方法
1.氰化亚铜的生产方法有亚硫酸钠法、亚硫酸钠循环法、氯化亚铜法。常彩亚硫酸钠循环法,该法具有操作稳定,控制方便,可节省亚硫酸钠原料等优点。其工艺流程如下。本方法对原料中含铁量要求较高,除确保工业原料纯度外,硫酸铜含铁量<0.05%,碳酸钠含铁量≤0.005,氰化钠含铁量≤0.005,碳酸和硫酸中的含铁量≤0.001%。因此在合成氰化亚铜前应对原料进行含铁量处理。
氰化钠溶液的制备与处理 在溶解槽内用水将氰化钠和碳酸钠溶解配成含氰化钠130 g/L,碳酸钠60 g/L,加入少量的氢氧化钠吸收氰化纳水解时产生的微量氰化氢。此时Fe3+形成Fe(OH)3沉淀,转入沉降槽沉降16 h,上清液经检验合格后打入高位槽备用。
硫酸铜溶液的制备与处理 将硫酸铜用水溶解后,用10%的碳酸钠溶液将pH值调至5~5.3,然后用次氯酸钠(10%)溶液把Fe2+氧化成Fe3+,用水稀释至硫酸铜280 g/L转移到沉降槽静置48 h,澄清液化验合格备用。
亚硫酸钠溶液的配制及处理 在溶解槽内将亚硫酸钠,碳酸钠用水溶解,配成含亚硫酸钠150 g/L,碳酸钠40 g/L的溶液,再加入少许烧碱,使铁离子沉淀,在沉降槽中沉降16 h,上清液化验合格后抽入高位槽备用。

氰化亚铜的合成 将上述制备的硫酸铜和亚硫酸钠溶液自高位槽中计量放入反应釜中,在不断搅拌下生成亚硫酸铜和亚硫酸亚铜复盐糊状沉淀。再自高位槽计量放出氰化钠溶液,有碳酸钠中和副产物硫酸,充分搅拌反应完成后,用稀硫酸调pH值至1~2。用水浮洗除去FeSO4,Na2SO4等杂质。结晶放入真空干燥器内,真空干燥即得成品。
1kg CuSO4溶于3.2L水中(40~50℃)。280g NaHSO3溶于800mL水中(50~80℃)。280g NaCN溶于800mL水中(50~80℃)。每种溶液均在60℃过滤。将NaHSO3溶液在1~2min内倒入CuSO4溶液,接着立即倒入NaCN溶液。有少量SO2放出。10min后将热溶液过滤。产品用沸水洗涤,再用乙醇洗,在100℃干燥,得到细软粉末。
2.硫酸法:在溶解槽内将氰化钠和碳酸钠用水在30~40℃溶解成含氰化钠130g/L、碳酸钠60g/L的溶液,加入少量氢氧化钠,以吸收氰化钠水解时产生的微量氰化氢气体,并使Fe3+ 、Fe2+、Ca2+ 、Mg2+ 生成氢氧化物沉淀,沉降16h后分离得合格清液,供反应用。将硫酸铜用水在30~40℃溶解,加入15%~20%碳酸钠溶液,调ph至5~5.3,加入10%次氯酸钠使二价铁氧化成三价铁,配成含硫酸铜280g/L的溶液,沉降48H,分离清液含Fe<20×10-6,供反应用。将亚硫酸钠、碳酸钠用水在30~35℃溶解成含亚硫酸钠150g/L、碳酸钠40g/L的溶液,再加入少量氢氧化钠,使Fe2+、Ca2+ 、Mg2+ 生成氢氧化物沉淀,沉降16H,分离清液含Fe<20×10-4后,供反应用。将上述配制好的硫酸铜、亚硫酸钠与碳酸钠溶液,在搅拌下反应生成亚硫酸铜与亚硫酸亚铜的复盐糊状沉淀,再将氰化钠与碳酸钠溶液进行反应生成白色氰化亚铜。反应生成的硫酸被碳酸钠中和,并加稀硫酸调PH至1~2,使沉淀状态的铁变成可溶性Fe2+在漂洗时洗掉,并使CO32- 变成CO2气体放出。反应后的物料用水漂洗除去硫酸钠,再经离心分离,真空干燥,即得氰化亚铜成品。其反应式如下:
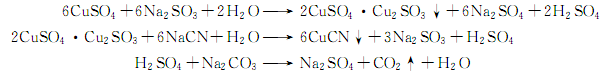
用途
1.本品在氰化物镀铜的电镀液中作络合剂,镀液的分散性和覆盖性较好,镀层结晶细致,而且镀渡呈碱性,有一定的去污性。对于钢铁制品和锌制品等基体金属上直接电镀铜层可获得结合力良好的镀层。其缺点是该镀液有剧毒,用此液镀铜必须进行三废处理,以保护环境,减少公害。
2.氰化亚铜是提供镀铜或镀铜合金镀液中铜离子的主盐,镀液中铜离子浓度与阴极过程有较大的影响,铜离子含量低时,阴极极化值增大,电流效率显著下降,允许的工作电流密度低,也用作化学浸镀锡及化学镀铜的稳定剂等。
3.氰化亚铜是有机Cu(I)试剂和有机Cu(II)试剂的有效前体[1]。
氰化亚铜与烷基锡形成的Me3SnCu(CN)Li试剂能与炔基羧酸酯反应得到3-三甲基锡-2-烯基羧酸酯,并且控制不同的温度能选择性得到顺式或反式产物 (式1)。
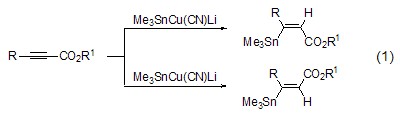
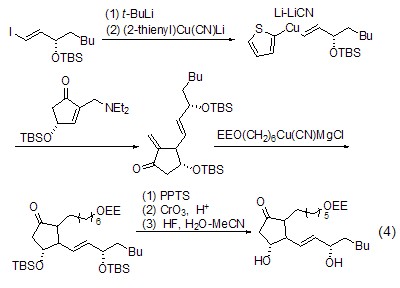
类似的,氰化亚铜与烷基锂形成的烯基铜试剂能作用于α,β-不饱和酮得到加成产物,并进一步发生分子内成环反应 (式2)[2]。

从有机锡化合物制备而来的α-烷氧基铜试剂也能与α,β-不饱和酮发生加成反应 (式3)[3]。

2-噻吩基铜试剂能在丁基锂作用下与碘代烯烃发生金属-卤素交换反应得到烯基铜,进而也能与α,β-不饱和酮发生加成反应。这种合成方法对于前列腺素的合成显得非常重要(式4)[4]。
4.用于电镀铜及其他合金,合成抗结核药及防污涂料。[17]
安全信息
危险运输编码:UN 1587 6.1/PG 2
危险品标志: 极毒
极毒  危害环境
危害环境
文献
1. (a) Lipshutz, B. H.; Sengupta, S. Org. React., 1992, 41, 135. (b) Chapdelaine, M. J.; Hulce, M. Org. React., 1990, 38, 225. 2. Piers, E.; Karunaratne, V. Chem. Commun., 1983, 935. 3. Linderman, R. J.; Godfrey, A.; Horne, K. Tetrahedron Lett., 1987, 28, 3911. 4. Okamoto, S.; Kobayashi, Y.; Kato, H.; Hori, K.; Takahashi, T.; Tsuji, H.; Sato, F. J. Org. Chem., 1988, 53, 5590. [1~4]参考书:现代有机合成试剂<性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7 [5~17]参考书:危险化学品安全技术全书.第一卷/张海峰主编.—2版.北京;化学工业出版社,2007.6 ISBN 978-7-122-00165-8
备注
暂无




 沪公网安备 31010602001115号
沪公网安备 31010602001115号