| 物竞编号 | 01HQ |
|---|---|
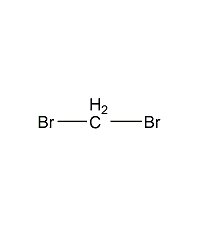
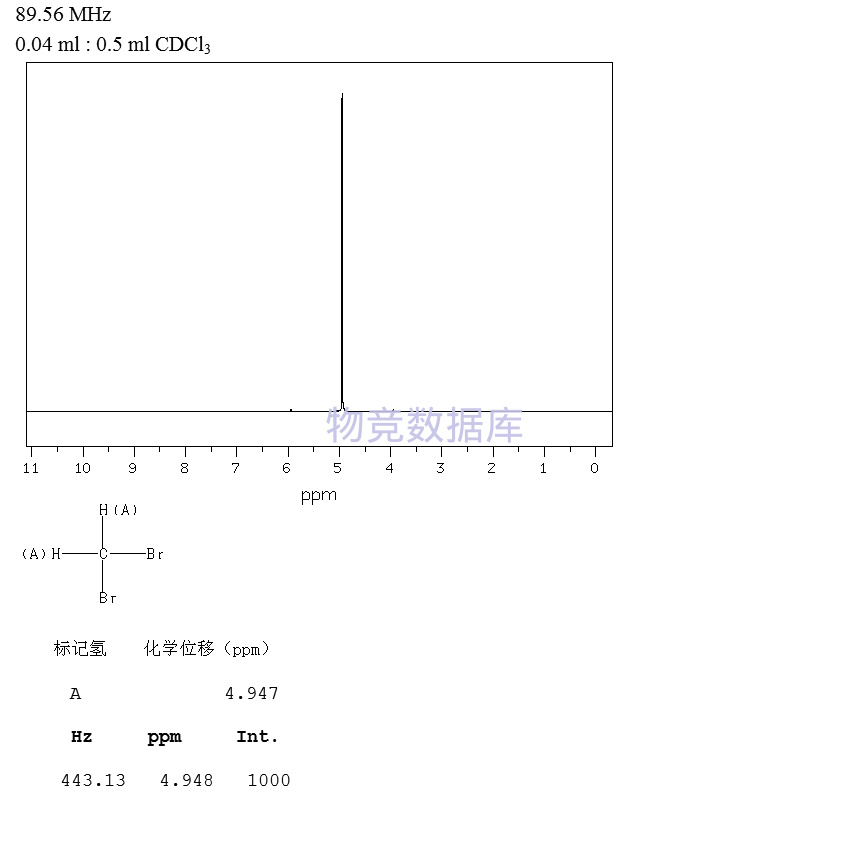
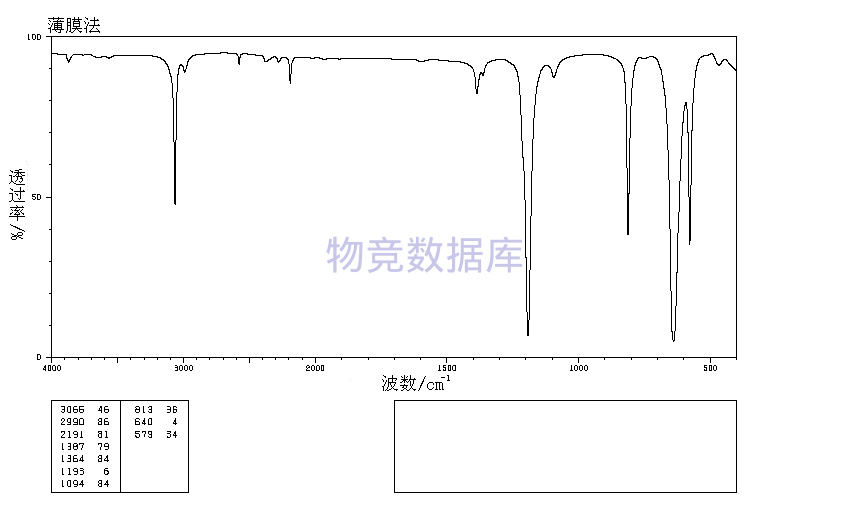
| 分子式 | CH2Br2 |
| 分子量 | 173 |
| 标签 | 溴化次甲基, 溴化亚甲基, 亚甲基二溴, 二溴亚甲基, Methylene dibromide, Methylene bromide, 脂肪族卤代衍生物 |
编号系统
CAS号:74-95-3
MDL号:MFCD00000168
EINECS号:200-824-2
RTECS号:PA7350000
BRN号:969143
PubChem号:24893828
物性数据
1.性状:无色透明液体[9]
2.熔点(℃):-52.5[10]
3.沸点(℃):96~98[11]
4.相对密度(水=1):2.48[12]
5.相对蒸气密度(空气=1):6.05[13]
6.饱和蒸气压(kPa):5(20℃)[14]
7.临界温度(℃):309.8[15]
8.临界压力(MPa):7.15[16]
9.辛醇/水分配系数:1.7[17]
10.溶解性:微溶于水,可混溶于乙醇、乙醚、丙酮、氯仿。[18]
11.黏度(mPa·s,20ºC):10.2
12.蒸发热(KJ/kg,b.p.):36.46
13.比热容(KJ/(kg·K),20ºC):0.66
14.热导率(W/(m·K),20ºC):0.1026
15.相对密度(20℃,4℃):1.4970
16.相对密度(25℃,4℃):1.4842
17.偏心因子:0.210
18.溶度参数(J·cm-3)0.5:22.344
19.van der Waals面积(cm2·mol-1):5.530×109
20.van der Waals体积(cm3·mol-1):39.430
21.液相标准热熔(J·mol-1·K-1):105.1
22.气相标准熵(J·mol-1·K-1) :293.39
23.气相标准热熔(J·mol-1·K-1):54.55
毒理学数据
1、急性毒性:大鼠口经LD50:108 mg/kg;大鼠吸入LC50:40 gm/m3/2H; 小鼠皮下注射LD50:3738 mg/kg;兔子口经LD50:1 mg/kg;兔子Administration onto the skin LD50:>4 mg/kg;兔子直肠LDLo:5 mg/kg;
2、致突变:沙门氏菌基因突变的微生物测试系统:100 ng/plate;沙门氏菌基因突变的微生物测试系统:10 ug/plate;仓鼠肺细胞遗传学分析试验系统:1 umol/L;
3.急性毒性[19]
LD50:1000mg/kg(大鼠经口)
LC50:40000mg/m3(大鼠吸入,2h)
4.刺激性 暂无资料
5.亚急性与慢性毒性[20] 大鼠吸入1000ppm,54次,引起肝、肾损害,部分动物死亡。
生态学数据
1.生态毒性 暂无资料
2.生物降解性[21]
好氧生物降解(h):168~672
厌氧生物降解(h):672~2688
3.非生物降解性[22]
空气中光氧化半衰期(h):851~8510
一级水解半衰期(h):1.60×106
分子结构数据
1、摩尔折射率:19.04
2、摩尔体积(cm3/mol):74.7
3、等张比容(90.2K):163.8
4、表面张力(dyne/cm):23.1
5、极化率(10-24cm3):7.55
计算化学数据
1.疏水参数计算参考值(XlogP):1.8
2.氢键供体数量:0
3.氢键受体数量:0
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积0
7.重原子数量:3
8.表面电荷:0
9.复杂度:2.8
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
1.稳定性[23] 稳定
2.禁配物[24] 强氧化剂、铝、镁
3.避免接触的条件[25] 光照、受热
4.聚合危害[26] 不聚合
5.分解产物[27] 溴化氢
贮存方法
储存注意事项[28] 储存于阴凉、通风的库房。远离火种、热源。保持容器密封。应与氧化剂、铝、金属粉末、食用化学品分开存放,切忌混储。储区应备有泄漏应急处理设备和合适的收容材料。
合成方法
1.三溴甲烷法 先用三氧化二砷和液碱反应,配制亚砷酸钠液。将亚砷酸钠液加热至65℃,在搅拌下徐徐加入溴仿,全部加完后继续搅拌回流4h,使反应完全,将反应物倾入5~6倍水中,吸出油状物,进行分馏。再用水洗至中性,用氯化钙脱水、精馏,得产品。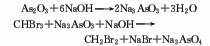
2.二氯甲烷法 在工业上尚有将无水CH2CL2在无水ALBr3催化下与HBr反应制取,同时还产生氯溴甲烷。
3.溴氯甲烷溴化氢法 反应式如下:
用途
1.有机合成原料。可作溶剂、制冷剂、阻燃剂和抗爆剂组分;在医药上用作消毒剂和镇静剂;还用于农药腈菌唑和其他有机合成等。
2.二溴甲烷能参与亲核取代反应,其反应活性介于二氯甲烷和二碘甲烷之间,通常弱于一般的烷基溴试剂。
二溴甲烷是一个有效的亚甲基羧醛形成试剂,因而它参与的反应通常不可逆。不仅能形成顺式羧醛,而且还能与糖类化合物反应形成稳定的反式羧醛 (式1)[1]。由于反应底物羟基的存在,反应可以在极性溶剂如水中进行,但需要相转移试剂如溴化四丁基铵的参与。
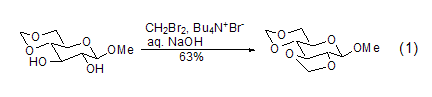
类似的反应还可以采用其它相转移催化剂如烷基三甲基铵来实现邻苯二酚的亚甲基羧醛化反应 (式2)[2] 和巯基苯酚的单硫羧醛化反应 (式3)[3]。
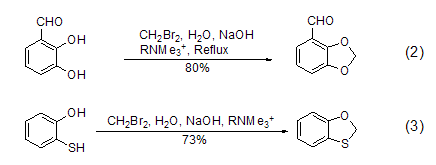
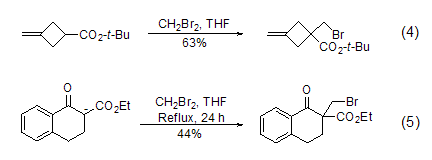
二溴甲烷还能用于烯醇式阴离子的单溴化反应。由于烯醇式阴离子通常都能产生很高的空间位阻,因此与二溴甲烷不会发生双取代反应。典型的例子如环丁烷羧酸酯 (式4)[4] 和四氢萘酮羧酸酯的溴甲基化反应 (式5)[5]。
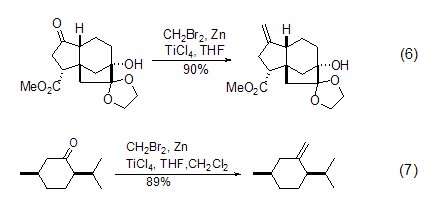
二溴甲烷与Zn和TiCl4组成的混合试剂能在温和条件下高产率地将羰基C=O转换为C=CH2,是一个有效的羰基化合物的亚甲基化试剂。这种混合试剂与传统的Wittig试剂相比最大的优点是不会导致酮的烯醇化反应,因此用途非常广泛,如天然产物的合成 (式6)[6] 以及普通手性试剂的转换 (式7)[7]。
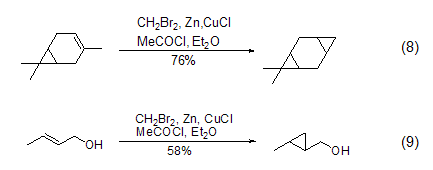
二溴甲烷还能取代二碘甲烷参与烯烃的环丙烷化反应 (式8,式9)[8]。该反应需要金属Zn的参与,并且Zn的活性会极大影响反应的产率。通常是加入氯化亚铜或乙酰氯来活化金属Zn,进而形成反应中间体(溴甲基)溴化锌来实现环丙烷化反应。
3.用于有机合成,用作溶剂。[29]
安全信息
危险运输编码:UN 2664 6.1/PG 3
危险品标志: 有害
有害
文献
1. Kim, K. S.; Szarek, W. A. Synthesis, 1978, 48. 2. Bashall, A. P; Collins, J. F. Tetrahedron Lett., 1975, 3478. 3. Cabiddu, S.; Maccioni, A.; Secci, M. Synthesis, 1976, 797. 4. Shaw, J. E.; Kunerth, D. C. J. Org. Chem., 1974, 39, 1968. 5. Bowman, W. R.; Westlake, P. J. Tetrahedron, 1992, 48, 4027. 6. Lombardo, L. Tetrahedron Lett., 1982, 23, 4193. 7. Lombardo, L. Org. React., 1987, 65, 81. 8. Friedrich, E. C.; Lewis, E. J. J. Org. Chem., 1990, 55, 2491. [1~8]参考书:现代有机合成试剂<性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7 [9~29]参考书:危险化学品安全技术全书.第一卷/张海峰主编.—2版.北京;化学工业出版社,2007.6 ISBN 978-7-122-00165-8
备注
暂无




 沪公网安备 31010602001115号
沪公网安备 31010602001115号