| 物竞编号 | 0V6X |
|---|---|
| 分子式 | C13H18AlClTi |
| 分子量 | 284.58 |
| 标签 | 双(环戊二烯基)-μ-氯化(二甲基铝)-μ-亚甲基钛, Bis(cyclopentadienyl)-μ-chloro(dimethylaluminum)-μ-methylenetitanium, Tebbe reagent,Tebbe试剂 |
编号系统
CAS号:67719-69-1
MDL号:MFCD00151575
EINECS号:暂无
RTECS号:暂无
BRN号:暂无
PubChem号:24863730
物性数据
1.性状:较纯的Tebbe试剂为红色的固体。
2.溶解性:溶于大多数芳烃溶剂和极性有机溶剂,但几乎不溶于烷烃。
毒理学数据
暂无
生态学数据
对水稍微有危害的,不要让未稀释或者大量产品接触地下水,水道或者污水系统。若无政府许可,勿将材料排入周围环境。
分子结构数据
暂无
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:4
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积0
7.重原子数量:16
8.表面电荷:0
9.复杂度:68.6
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:6
性质与稳定性
1. 远离氧化物,水分/潮湿。
2. 对空气和湿气敏感。正常操作需要在手套箱和惰性气体保护下进行。
贮存方法
存放在密封容器内,并放在阴凉,干燥处。储存的地方必须上锁,钥匙必须交给技术专家和他们的助手保管。储存的地方必须远离氧化剂。避免接触湿气和水源。
合成方法
暂无
用途
Tebbe试剂[1]在有机合成中有着非常特殊的重要用途,主要被用于羰基的乙烯基化反应,这个反应也称之为Tebbe成烯反应。它可以将醛、酮、酯或者酰胺分子中的羰基转变成为多一节碳的末端烯,但是与酰胺反应的应用举例不多[2]。
Tebbe试剂可以简单地看作是“CpTi=CH2”的一个前体化合物。虽然它与醛的反应生成末端烯也许可以由Wittig试剂来完成,但是由于Tebbe试剂较高的反应活性,一般情况下可以得到较高的产率。即使对于那些具有复杂结构的底物分子,该试剂也具有很好的化学选择性 (式1)[3,4]。Tebbe试剂较高的反应性和反应中使用弱碱的特点,使得它与邻位有手性碳原子的醛发生反应时也能够保持原来的构型,不产生消旋化影响 (式2)[5,6]。

Tebbe试剂与酮反应非常顺利,有时甚至使用原位生成的Tebbe试剂也可以得到很好的结果[7]。如果使用Wittig试剂或者原位生成的Tebbe试剂明显地表现出产物产率较低的问题时,尝试使用Tebbe试剂有可能会获得较好的结果。在反应中适当地控制试剂的用量,可以在羧酸酯的存在下选择性地将酮转化为相应的末端烯烃 (式3)[8]。
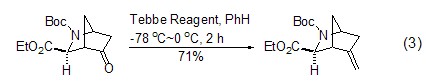
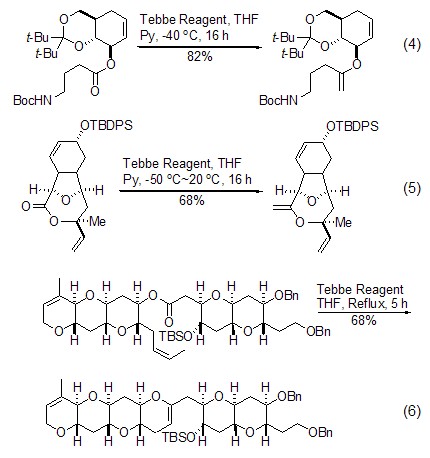
Tebbe试剂较高的反应活性也表现在能够与羧酸酯发生同样的反应,可以直接将酯转变成为相应的烯醇衍生物 (式4)[9,10]。该反应最独特的地方是与内酯反应生成具有环外双键的烯醇衍生物 (式5)[11]。Tebbe试剂发生的反应一般需要在较低的反应温度下进行,使用较高的温度或者过量太多的Tebbe试剂反而会引起烯烃复分解而导致产物产率的降低。但是,有人巧妙地利用了这一特点,使用Tebbe试剂完成了Tebbe成烯反应和烯烃复分解的联串反应,一步反应得到了烯醚的产物 (式6)[12]。
安全信息
危险运输编码:UN 2924 3/PG 2
危险品标志: 易燃
易燃  腐蚀
腐蚀
安全标识:S26 S45 S62 S36/S37/S39
危险标识:R11 R34 R63 R65 R67 R48/20
文献
1. Tebbe, F. N.; Parshall, G. W.; Reddy, G. S. J. Am. Chem. Soc., 1978, 3611. 2. Cannizzo, Louis F.; Grubbs, Robert H. J. Org. Chem., 1985, 50, 2316. 3. Nicolaou, K. C.; Snyder, S. A.; Huang, X.; Simonsen, K. B.; Koumbis, A. E.; Bigot, A. J. Am. Chem. Soc., 2004, 126, 10162. 4. Uttaro, J.-P.; Audran, G.; Monti, H. J. Org. Chem., 2005, 70, 3484. 5. Chen, G.; Schmieg, J.; Tsuji, M.; Franck, R. W. Org. Lett., 2004, 6, 4077. 6. Fuwa, H.; Sasaki, M.; Tachibana, K. Org. Lett., 2001, 3, 3549. 7. Booker-Milburn, K. I.; Jenkins, H.; Charmant, J. P. H.; Mohr, P. Org. Lett., 2003, 5, 3309. 8. Bunch, L.; Liljefors, T.; Greenwood, J. R.; Frydenvang, K.; Brauner-Osborne, H.; Krogsgaard-Larsen, P.; Madsen, U. J. Org. Chem., 2003, 68, 1489. 9. Chambers, David J.; Evans, Graham R.; Fairbanks, Antony J. Tetrahedron: Asymmetry, 2005, 16, 45. 10. Rivkin, A.; Gonzalez-Lopez de Turiso, F.; Nagashima, T.; Curran, D. P. J. Org. Chem., 2004, 69, 3719. 11. Bernardelli, P.; Moradei, O. M.; Friedrich, D.; Yang, J.; Gallou, F.; Dyck, B. P.; Doskotch, R. W.; Lange, T.; Paquette, L. A. J. Am. Chem. Soc., 2001, 123, 9021. 12. Nicolaou, K. C.; Postema, M. H. D.; Claiborne, C. F. J. Am. Chem. Soc., 1996, 118, 1565. 13.参考书:现代有机合成试剂<性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无

![μ-氯-μ-亚甲基[二(环戊二烯基)钛]-二甲基铝结构式](http://staticv5.basechem.org/img/tupu/old/f53681754dcb4bdaa0472a4215a0ff5e.gif)



 沪公网安备 31010602001115号
沪公网安备 31010602001115号