| 物竞编号 | 03W3 |
|---|---|
| 分子式 | NaCN |
| 分子量 | 49.01 |
| 标签 | 山奈钠, : 山柰, Cianuro disodio, 媒染剂, 增白剂, 掩蔽剂, 淬火剂, 印刷线路板电镀用原材料 |
编号系统
CAS号:143-33-9
MDL号:MFCD00003523
EINECS号:205-599-4
RTECS号:VZ7525000
BRN号:3587243
PubChem号:24886191
物性数据
1.性状:白色或略带颜色的块状或结晶状颗粒,有微弱的苦杏仁味。[9]
2.熔点(℃):563.7[10]
3.沸点(℃):1496[11]
4.相对密度(水=1):1.596[12]
5.饱和蒸气压(kPa):0.13(817℃)[13]
6.辛醇/水分配系数:-1.69[14]
7.溶解性:易溶于水,溶于液氨,微溶于乙醇、乙醚、苯。[15]
毒理学数据
1、急性毒性:
大鼠经口LD50:6440 ug/kg;大鼠腹腔LD50:4300 ug/kg;小鼠腹腔LD50:4900 ug/kg;小鼠皮下LD50:3600 ug/kg;兔子经皮LD50:10400 ug/kg;兔子皮下LD50:2200 ug/kg。
2.急性毒性[16] LD50:6.4mg/kg(大鼠经口)
3.刺激性 暂无资料
4.其他[17] 仓鼠植入最低中毒剂量(TDLo):5999mg/kg(孕6~9d),引起胚胎毒性,肌肉骨骼发育异常及心血管(循环)系统发育异常。
生态学数据
1.生态毒性 暂无资料
2.生物降解性 暂无资料
3.非生物降解性 暂无资料
4.其他有害作用[18] 该物质对环境有危害,应特别注意对水体的污染。
分子结构数据
1、摩尔折射率:无可用的
2、摩尔体积(cm3/mol):无可用的
3、等张比容(90.2K):无可用的
4、表面张力(dyne/cm):无可用的
5、介电常数:无可用的
6、极化率(10-24cm3):无可用的
7、单一同位素质量:48.992844 Da
8、标称质量:49 Da
9、平均质量:49.0072 Da
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:2
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积23.8
7.重原子数量:3
8.表面电荷:0
9.复杂度:12.8
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:2
性质与稳定性
1.在1.34℃以下水溶液易结晶出来的氰化钠,常含有1个或2个结晶水。34.7℃以上时,则失去结晶水,成为强碱弱酸盐。易与酸作用,甚至很弱的酸亦能与之反应。铁、锌、镍、铜、钴、银和镉等金属溶解于氰化钠溶液,产生相应的氰化物。在氧的参与下,能溶解金和银等贵金属,生成络合盐。剧毒!
2.密度:立方晶体1.60g/cm3。溶解度g/100gH2O40.8(0℃),58.7(20℃),71.2(30℃)。稍溶于醇。
3.试剂有剧毒,对眼睛有强烈的刺激,具有吸湿性,易通过皮肤吸收。应避免吸入氰化钠粉尘颗粒。如果氰化钠不慎被吸入,吞服或者通过皮肤进入人体,将有致命危险。氰化钠中毒能致使肺部疼痛和人体青紫(人体LDL0: 2857 μg/kg;或者鼠LD50: 6440 μg/kg)。应储存在干燥的地方,使用时应在通风橱中进行。与酸不共存,可以和二氧化碳反应。在潮湿的空气和水中可能分解。热分解产生有毒的氰化氢、一氧化碳、二氧化碳、氮氧化合物烟雾。
4.稳定性[19] 稳定
5.禁配物[20] 酸类、强氧化剂
6.避免接触的条件[21] 潮湿空气
7.聚合危害[22] 不聚合
贮存方法
储存注意事项[23] 储存于阴凉、干燥、通风良好的专用库房内。实行“双人收发、双人保管”制度。远离火种、热源。库内相对湿度不超过80%。包装密封。应与氧化剂、酸类、食用化学品分开存放,切忌混储。储区应备有合适的材料收容泄漏物。
合成方法
1.目前工业生产以丙烯腈副产法为主。
(1)氨钠法将金属钠和石油焦按一定比例,加入反应器中,加热至650℃,通入氨气,升温至800℃,反应7h,金属钠全部转化为氰化钠。反应物经保温650℃过滤,以除去过量石油焦,熔融物放出经浇铸成型而得氰化钠产品。其
(2)氰熔体法将氰熔体和氧化铅加入萃取槽中,其配料比为(500~700):l,加入氧化铅因生成PbS沉淀,起到脱硫作用。萃取液经沉降,排出清液含NaCN 80~90 g/L,在发生器中与浓硫酸反应生成氢氰酸气体,经冷凝除水后,进入吸收反应器内用液碱吸收,生成氰化钠。其反应如下:
(3)安氏法以天然气、氨和空气为原料。天然气经水洗塔脱去无机硫和部分有机硫,经过滤使精制后的天然气含硫量≤l mg/m3、C2以上的烃类在2%以下,液氨经汽化器汽化,空气经过滤器精滤。将三种原料气按氨:甲烷:空气:1:(1.15~1.17):(6.70~6.80)的比例,经混合器混合进入氧化反应器,以铂铑合金为触媒,于1070~1120℃温度下,反应生成含8.5%的混合气体,经冷却后进氨吸收塔,用硫酸吸收残余氨,然后经水冷却,用低温水吸收氰化氢,尾气经碱洗塔后排空。水吸收氰化氢溶液经换热后进入解吸塔,塔顶得纯度98%HCN,再与碱液反应,生成氰化钠溶液,经蒸发、结晶、干燥、成型,制得成品。其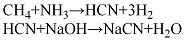
(4)火焰法以天然气、氧气、氨为原料,分别经过滤器滤去杂质,稳压计量后进人混合器。氧气一部分做主氧进混合器,另一部分直接进喷嘴作点火用。三种原料气按一定比例配合,在温度1500℃下进行合成氢氰酸的燃烧反应,反应气经喷水淬冷、冷却器冷却,进氨吸收塔,以15%~20%硫酸吸收反应气中的残余氨,可回收硫酸铵。含氰化氢的反应气经水冷,用低温水吸收氰化氢而成1.5%溶液,经精馏塔精馏可得含量98%~99%的氰化氢,再经碱液吸收、蒸发、结晶、干燥、成型,制得氰化钠成品。其主要反应如下: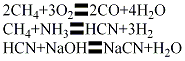
水吸收氰化氢后的尾气含氢气65%、一氧化碳约30%,可回收制合成氨、甲醇、草酸等产品。
(5)轻油裂解法将轻油和氨按比例在雾化器中混合,预热至280℃,在电弧炉中裂解反应,以石油焦作载体,以氮气作保护气进行密闭防氧化,温度1450℃,反应生成氢氰酸气体,经除尘、冷却后,再经除氨、水洗、吸收、精馏而得纯净的氢氰酸,再用碱液吸收生成氰化钠。其反应如下: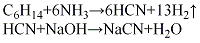
(6)丙烯腈副产法在丙烯氨氧化法制丙烯腈的过程中,副产氰化氢气体(其量相当于丙烯腈产量的4%~10%),经碱液吸收,再经蒸发、浓缩、分离、干燥,制得氰化钠产品。其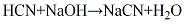
将1L含NaOH不超过40g的无水乙醇溶液用冰冷却。向该溶液中加入稍过量的液体氰化氢。长时间放置此溶液,可析出结晶,抽滤,在P2O5干燥器中减压干燥。
用途
1.用作各种钢的淬火剂,镀铜、银、镉、锌等的主要组分,用于提取金、银等贵重金属,也是氰化物和氢氰酸的原料。
2.在机械工业中用作各种钢的淬火剂。电镀工业中作为镀铜、银、镉和锌等的主要组分。冶金工业中用于提取金、银等贵重金属。化学工业中是制造各种无机氰化物和发生氢氰酸的原料,也用于制造有机玻璃、各种合成材料、丁腈橡胶、合成纤维的共聚物。染料工业中用于制造三聚氰氯(活性染料中间体,又为生产增白剂的原料)。医药工业中用于制造氰乙酸甲酯和丙二酸二乙酯等。纺织工业中用作媒染剂,还用于钢的液式渗碳,渗氮。
直接利用氰化钠生产的重要无机氰化物主要有黄血盐钠、黄血盐钾、氰化钾、氰化锌、氰化钡、氰化亚铜、硫氰化钠、硫氰化钾;有机氰化物有氰乙酸、丙二腈、蛋氨酸、氰苄、三聚氰氯等。利用氰化钠发生氰化氢再生产的主要产品有:甲基丙烯酸甲酯、甲基丙烯酸丁酯、甲基丙烯酸、偶氮二异丁腈、偶氮二异庚腈、次氨基三乙酸、羟乙腈等。
3.在分析上用作掩蔽剂,在冶炼、电镀工业中用作铬合剂,还用于昆虫激素的研究。
4.用于塑料、医药、农药、染料、冶金、电镀、选矿等行业,也用作制氢氰酸原料。络合剂。掩蔽剂。提炼金银矿用。
5.氰化钠在电镀溶液中可使阳极极化作用降低,保证阳极正常溶解,稳定镀液并能提高阴极极化作用,获得均匀的镀层。
6.氰化钠可以用来制备氰基化合物[2,3],氰醇类化合物[4,5],α-氨基氰基化合物[6],也可以用作催化剂,如安息香缩合反应。
氰基化合物的合成 在合适的溶剂中,活泼醇或卤化物与氰化钠反应可以得到氰化物,此反应为亲核取代反应,是氰化物合成的通用方法。在DMSO中,氰化钠与烷基氯反应时,氰基钠比氰化钾的反应产率高,且反应时间要短 (式1)[2]。

在微波条件下,氰化钠与芳基卤化物的反应是一种快速制备芳基氰化物的方法 (式2)[3]。反应快速且产率很高,是一种很好合成芳基氰化物的方法。
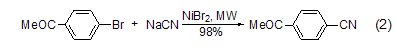
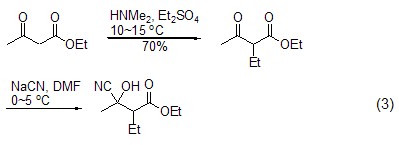
氰醇类化合物的合成 Gurjar和Joshi等人在合成顺、反式羟基格列美脲的过程中,以β-羰基丁酸乙酯为原料,通过两步反应生成腈醇类化合物,产率较高 (式3)[4]。
α-氨基氰基化合物的合成 在钌催化和氧气存在下,三级胺与氰化钠反应生成α-氨基氰化合物 (式4)[7],溶剂为甲醇和乙酸 (3:1) 的混合物。氧化氰化得到的叔胺是合成α-氨基酸的前体,因此,该方法提供了快捷方便的合成α-氨基酸的途径。
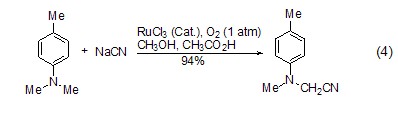
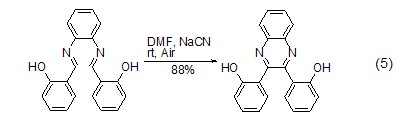
成环作用 氰化钠可用作亚胺类化合物二聚成喹喔啉或吡嗪的催化剂,此反应类似于安息香缩合 (式5)[8]。在DMF、甲醇或二氯甲烷/水 (相转移条件) 中,氰化钠快速促进分子内环化得到六元环。
7.用于提炼金、银等贵重金属和淬火,并用于塑料、农药、医药、染料等有机合成工业。[24]
安全信息
危险运输编码:UN1689 6.1/PG 1
危险品标志: 极毒
极毒  危害环境
危害环境
文献
1. Perrin, D. D.; Armarego, W. L. F. Purification of Laboratory Chemicals, 3rd Ed.; Pergamon: New York, 1988; p 369. 2. Friedman, L.; Shechter, H. J. Org. Chem., 1960, 25, 877. 3. Arvela, R. K.; Leadbeater, N. E. J. Org. Chem., 2003, 68, 9122. 4. (a) Gurjar, M. K.; Joshi, R. A.; Chaudhuri, S. R.; Joshi, S. V.; Barde, A. R.; Gediya, L. K.; Ranade, P. V.; Kadam, S. M.; Naik, S. J. Tetrahedron Lett., 2003, 44, 4853. 5. Raj, I. V. P.; Sudalai, A. Tetrahedron Lett., 2005, 46, 8303. 6. Murahashi, S. -I.; Komiya, N.; Terai, H. Angew. Chem., Int. Ed., 2005, 44, 6931. 7. Murahashi, S. I.; Naruyoshi, K ; Hiroyuki, T.; Takahiro, N. J. Am. Chem. Soc., 2003, 125, 15312. 8. Reich, B. J. E.; Justice, A. K.; Beckstead, B. T.; Reibenspies, J. H.; Miller, S. A. J. Org. Chem., 2004, 69, 1357. [1~8]参考书:现代有机合成试剂<性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7 [9~24]参考书:危险化学品安全技术全书.第一卷/张海峰主编.—2版.北京;化学工业出版社,2007.6 ISBN 978-7-122-00165-8
备注
暂无

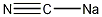



 沪公网安备 31010602001115号
沪公网安备 31010602001115号