| 物竞编号 | 03UQ |
|---|---|
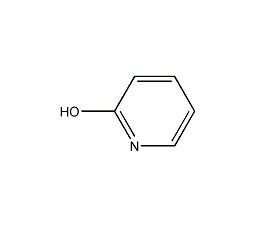
| 分子式 | C5H5NO |
| 分子量 | 95.10 |
| 标签 | 2-吡啶酚, 2-吡啶酮, 2-Pyridinol, 2-Pyridone, 两可亲核试剂 |
编号系统
CAS号:142-08-5
MDL号:MFCD00006268
EINECS号:205-520-3
RTECS号:UV1144050
BRN号:105786
PubChem号:暂无
物性数据
1.性状:白色或棕色晶体状粉末
2.密度(g/mL,25/4℃):1.391
3.闪点(℃):210
4.熔点(℃):104-109
5.沸点(ºC):280-281
6.相对密度:1.39
7.蒸气压(kPa,25ºC): 0.0003
8.燃烧热(KJ/mol):-2516
9.溶解性:溶于H2O、EtOH、CHCl3,部分溶于Et2O、C6H6,几乎不溶于轻石油、己烷。
毒理学数据
1、急性毒性:小鼠腹腔LD50:410 mg/kg;小鼠静脉LD50:750 mg/kg。
生态学数据
其它有害作用:该物质对环境可能有危害,对水体应给予特别注意。
分子结构数据
1、 摩尔折射率:26.22
2、 摩尔体积(cm3/mol):81.0
3、 等张比容(90.2K):216.4
4、 表面张力(dyne/cm):50.7
5、 极化率(10-24cm3):10.39
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:1
3.氢键受体数量:1
4.可旋转化学键数量:0
5.互变异构体数量:2
6.拓扑分子极性表面积29.1
7.重原子数量:7
8.表面电荷:0
9.复杂度:135
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
贮存方法
冷冻保存,在惰性气体下更好。
合成方法
在181~185 oC/24 mmHg下回流除去有色杂质,然后可以在EtOH、CHCl3/乙醚、C6H6、C6H6/己烷或CCl4中重结晶;经过连续的重结晶或者升华,或者两者联用可以得到纯品。
用途
2-吡啶酮是一种两可亲核试剂[1],能作为双烯发生[4+2]环加成[2],在肽合成中常用来形成活泼酯[3]。2-吡啶酮是经典的亚胺醇和酰胺互变异构的底物 (式1)[4]。
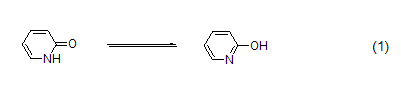
在极性溶剂中,该化合物更容易以吡啶酮的形式存在;当溶剂极性减小时,则会出现羟基吡啶与吡啶酮之间的平衡。而在气相中,则主要以羟基吡啶的形式存在。所以,亲核取代反应往往会产生混合物。在简单烷基化反应中,如果共轭碱2-吡啶酮作为亲核试剂,会生成N-烷基化产物。例如在碳酸钾存在下,向3-氯-5,5-二甲基-2-环己酮加入2-吡啶酮,得到共轭加成-消除产物 (式2)[5]。

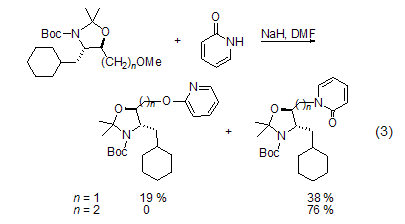
Pt或者Pd催化下,可以进行立体选择性地N-烷基化。溶剂和抗衡离子的作用影响反应:极性溶剂下易发生N-烷基化;而2-吡啶酮的Ag盐存在时,则易发生O-烷基化[2]。三乙胺存在下,用三甲基硅基三氟甲磺酸盐作为亲电试剂,会得到硅醚。同样地,2-吡啶酮与氯二甲基膦反应得到单一产物二甲基膦。2-吡啶酮与重氮甲烷的甲基化反应是动力学控制的,得到的N-甲基产物和O-甲基产物的比例是60:40;但与强亲电试剂反应则得到唯一的O-甲基化产物。此外,底物的结构也将影响烷基化的区域选择性 (式3)[6]。
2-吡啶酮在低温下乙酰化往往得到混合物;而温度逐渐恢复至室温,N-乙酰化产物会逐渐转化为在热力学上更加稳定的O-乙酰化异构体 (式4)[7]。2-吡啶酮的苯甲酰化和三氟甲基磺酰化只发生在氧上。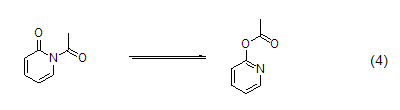
2-吡啶酮的[4+2]环加成通常很难发生[3]。因为2-吡啶酮更易于与亲双烯体发生共轭加成,但是 N-烷基衍生物,尤其是N-甲基和N-烯基衍生物,与反应活性高的亲双烯体丁炔二酸二甲酯、顺丁烯二酸酐或苯炔等在高温或高压下反应,生成异奎宁加成物 (式5)[8]。在加热条件下,这些加合物能够脱除异氰酸酯得到芳构化产物。相关的 N-苯磺酰基-3-(对磺酰基苄基)-2-吡啶酮能与亲双烯体烯丙基醚发生缺电子的Diels-Alder反应。这些成环反应在高压条件下更容易进行。

虽然N-(ω-烯基)-2-吡啶酮的分子内[4+2]环加成很难发生,但是一些光敏感分子内的[2+2]的环加成则是合成立体化学确定的三环内酯的一个好方法。一个例子是DMAD与亚甲胺叶立德发生专一的1,3-偶极环加成得到吲哚类化合物[9]。
2-吡啶酮可以用于固相多肽合成中“活性酯”的制备[3]。如果肽的合成在二氯甲烷中进行,则这些酯要比相应的对硝基苯酯更活泼。在制备氨基酸的2,2,2-三氯乙酯的反应中,2-吡啶酯作为中间体参与了反应 (式6)[10]。
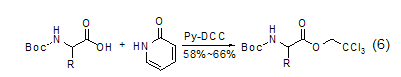
2-吡啶酮还可以作为金属化合物的配体参与反应[11]。
安全信息
危险运输编码:暂无
危险品标志: 刺激
刺激
危险标识:R36/37/38
文献
1. Smith. D. M. In Comprehensive Organic Chemistry;Barton, D. H. R.; Ollis, W. D. Eds.; Pergamon: New York, 1979, Vol. 4, p 55. 2. Posner, G. H.; Switzer, C. J. Org. Chem., 1987, 52, 1642. 3. Dutta, A. S.; Morley, J. S. J. Chem. Soc. (C), 1971, 2896. 4. Frank, J.; Katritzly, A. R. J. Chem. Soc. Perkin Trans 2, 1976, 1428. 5. Mariano, P. S.; Krochmal, E.; Beamer, R.; Huesmann, P. L.; Dunaway-Mariano, D. Tetrahedron, 1978, 34, 2609. 6. Raddatz, P.; Jonczyk, A.; Minck, K. O.; Rippmann, F.; Schittenhellm, C.; Schmitges, C. J. J. Med. Chem., 1992, 35, 3525. 7. McKillop, A.; Zelesko, M. J.; Taylor, E. C. Tetrahedron Lett., 1968, 4945. 8. Acheson, R. M.; Tasker, P. A. J. Chem. Soc. (C), 1967, 1452. 9. Padwa, A.;Austin, D. J.; Precedo, L.; Zhi, L. J. Org. Chem., 1993, 58, 1144. 10. Carson, J. F. Synthesis, 1979, 24. 11. (a) Steed, J. W.; Tocher, D. A. J. Chem. Soc. (D), 1992, 2765. (b) Lugan, N.; Laurent, F.; Lavigne, G.; Newcomb, T. P.; Liimatta, E. W.; Bonnet, J. J. Organomet. Chem., 1992, 11, 1351. 12.参考书:现代有机合成试剂<性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无

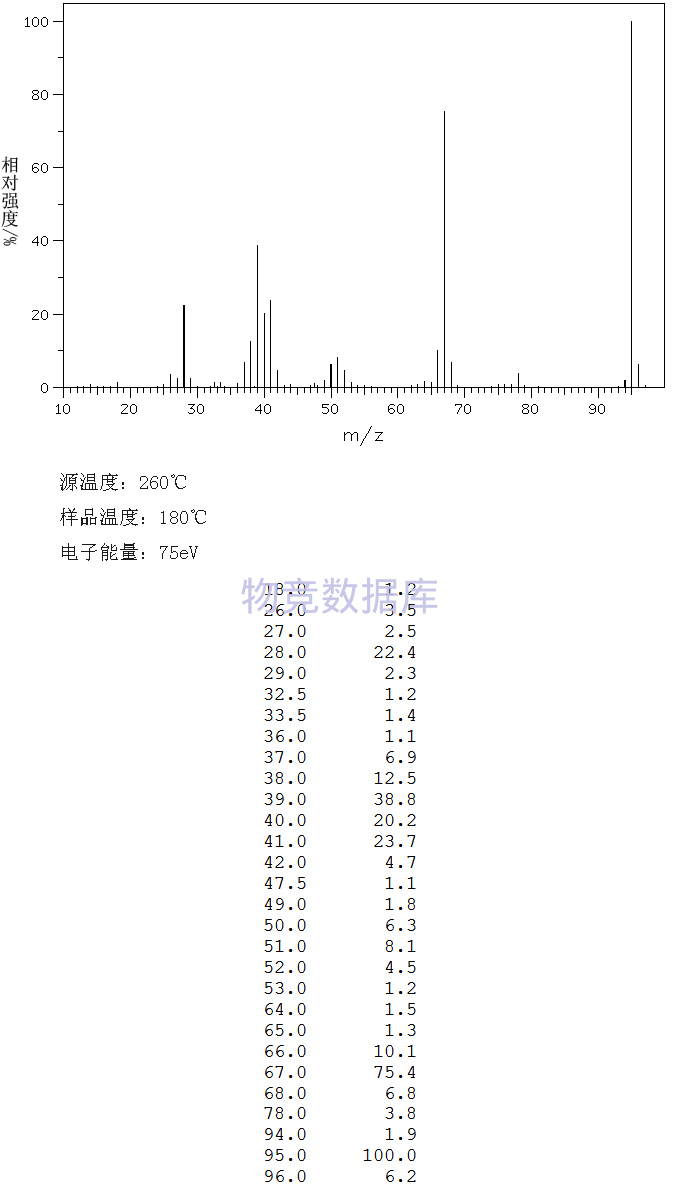
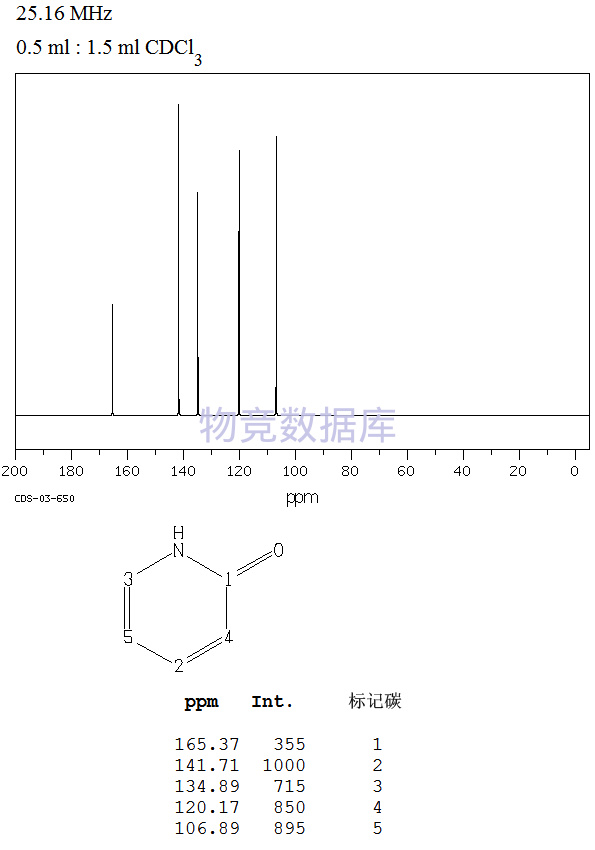
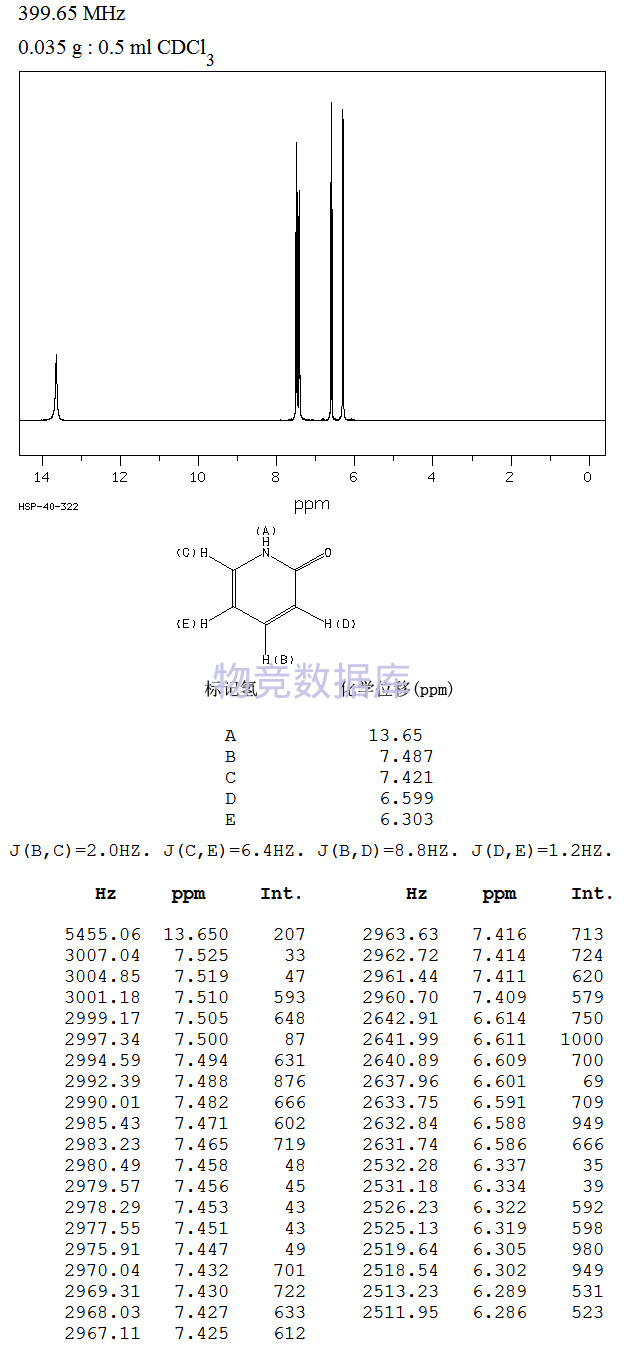


 沪公网安备 31010602001115号
沪公网安备 31010602001115号