| 物竞编号 | 03LD |
|---|---|
| 分子式 | C4H4BrNO2 |
| 分子量 | 177.99 |
| 标签 | N-溴代琥珀酰亚胺, N-Succinbromimide, 1-Bromo-2,5-pyrrolidine-dione, NBC |
编号系统
CAS号:128-08-5
MDL号:MFCD00005510
EINECS号:204-877-2
RTECS号:暂无
BRN号:暂无
PubChem号:暂无
物性数据
1. 性状:白色粉末或结晶
2. 密度(g/mL,25/4℃):2.097
3. 熔点(ºC,微分解):173~175
4. 溶解性:易溶于丙酮、乙酸乙酯、醋酐,难溶于水、苯、四氯化碳、氯仿等。
毒理学数据
暂无
生态学数据
暂无
分子结构数据
1、 摩尔折射率:30.06
2、 摩尔体积(cm3/mol):87.1
3、 等张比容(90.2K):250.0
4、 表面张力(dyne/cm):67.8
5、 极化率(10-24cm3):11.91
计算化学数据
1.疏水参数计算参考值(XlogP):-0.1
2.氢键供体数量:0
3.氢键受体数量:2
4.可旋转化学键数量:0
5.互变异构体数量:3
6.拓扑分子极性表面积37.4
7.重原子数量:8
8.表面电荷:0
9.复杂度:129
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
1.本品剧毒。对眼、黏膜和皮肤有强烈的刺激性。车间要通风良好。
2.生产设备应密闭,防止泄漏,操作人员要穿戴好防护用品。
3.对湿气敏感,应保存在冰箱中。使用过程中,应避免吸入或粘在皮肤上,一般在通风性能良好的通风橱中操作。
4.有强热的.刺激味,对眼、皮肤和粘膜有强刺激性。
贮存方法
合成方法
1.将琥珀酰亚胺 ( 丁二酰亚胺)溶于10倍质量的水中,脱色过滤清亮,然后在15℃下滴加与琥珀酰亚胺相同物质量的溴水并同时滴加20%的氢氧化钠溶液,控制溶液ph=7~8,滴加过程中即有白色结晶析出。加完后继续搅拌半小时,静置,过滤,用蒸馏水洗涤结晶数次至溴和丁二酰亚胺含量合格,甩干后,干燥,即得成品。
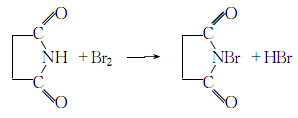
2.将160克(1.62摩尔)丁二酰亚胺溶解于64克(1.60摩尔)氢氧化钠、300克碎冰和400毫升水的混合中,在激热搅拌和冷却下,一次加入85毫升嗅(小心)。继续搅拌1一2分钟后滤出沉淀物。粗产物用冰水洗除残存的嗅,然后置于五氧化二磷干燥器中,在0.5毫米汞柱压力下千燥8小时;或置于千燥枪内(五氧化二磷),在40℃和10-20mm汞柱压力下干燥8小时,得220一230克(75一51%),纯度约为97%的产物。
用途
1.有机合成原料,用于调节低能溴化反应,也用于生产橡胶助剂和医药品。可合成溴乙腈医药。农药工业用于合成噻菌灵,还可用作水果保鲜剂以及防腐、防霉剂等。
2.用于光度法测定与其他黄酮类化合物共存的栎精。还用于有机合成。
3.溴化剂。烯烃澳化成反Markownikoff规律的产物。氧化剂。使醛氧化成酸溴后,可进一步反应得醋和酸胺。对烯丙基的氧化常优于三氧化铬-吡啶。它常与二甲基甲酸胺.或二甲基亚砜一起,作为更有效的溴化剂使用。
4.N-溴代丁二酰亚胺 (NBS) 常用于烯丙基、苄基的自由基溴化反应[1];酮、芳香化合物或杂环化合物的亲电溴化反应;烯烃的羟基化、成醚反应以及内酯化反应。
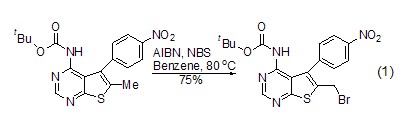
自由基溴化反应 在适当的条件下,NBS可以高效率的与烯丙基化合物发生自由基溴化反应,该反应具有很高的选择性 (式1)[1]。
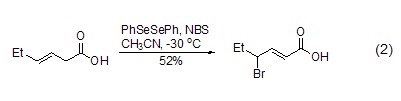
不饱和羧酸、醛、酯和内酯化合物也可使用NBS进行溴化,其中不饱和羧酸在溴化过程中,不饱和键可能经过迁移,生成α,β-不饱和羧酸 (式2)[2]。
亲电溴化反应 在NBS作用下,苯酚、苯胺以及其它电子云密度较大的芳香化合物能够高效率的生成邻位或对位溴化的产物 (式3)[3~5]。

与乙烯基或炔基化合物反应 在有机金属化合物的存在下,NBS能够将炔等化合物转化为相应的溴代物 (式4)[6]。
与碳-碳双键的加成 在其它亲核试剂的作用下,NBS可与烯烃等化合物发生加成反应 (式5)[7],亲核试剂包括醇、羧基、叠氮化合物、醇钠等。通过加成反应,可在产物中引入多种官能团,该方法是天然产物合成中一种比较常用的方法[8~11]。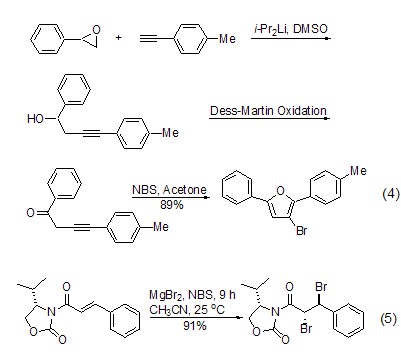
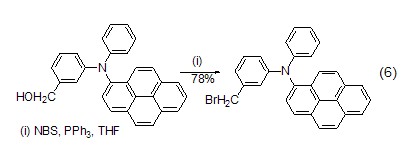
其它官能团的溴化反应 在极性溶剂中,NBS在PPh3的存在下,可将一级或二级醇转化为相应的溴化物 (式6)[12]。
安全信息
危险运输编码:暂无
危险品标志:暂无
安全标识:暂无
危险标识:暂无
文献
1. Dai, Y.; Guo, Y.; Frey, R. R.; Ji, Z.; Curtin, M. L.; Ahmed, A. A.; Albert, D. H.; Arnold, L.; Arries, S. S.; Barlozzari, T.; Bauch, J. L.; Bouska, J. J.; Bousquet, P. F.; Cunha, G. A.; Glaser, K. B.; Guo, J.; Li, J.; Marcotte, P. A.; Marsh, K. C.; Moskey, M. D.; Pease, L. J.; Stewart, K. D.; Stoll, V. S.; Tapang, P.; Wishart, N.; Davidsen, S. K.; Michaelides, M. R. J. Med. Chem., 2005, 48, 6066. 2. Mellegaard, S. R.; Tunge, J. A. J. Org. Chem., 2004, 69, 8979. 3. Herland, A.; Nilsson, K. P. R.; Olsson, J. D. M.; Hammarstroem, P.; Konradsson, P.; Inganaes, O. J. Am. Chem. Soc., 2005, 127, 2317. 4. Kim, Y.; Bouffard, J.; Kooi, S. E.; Swager, T. M. J. Am. Chem. Soc., 2005, 127, 13726. 5. Aratani, N.; Takagi, A.; Yanagawa, Y.; Matsumoto, T.; Kawai, T.; Yoon, Z. S.; Kim, D.; Osuka, A. Chem. Eur. J., 2005, 11, 3389. 6. Sniady, A.; Wheeler, K. A.; Dembinski, R. Org. Lett., 2005, 7, 1769. 7. Hajra, S.; Bhowmick, M.; Karmakar, A. Tetrahedron Lett., 2005, 46, 3073. 8. Cordonier, C. E. J.; Satake, K.; Atarashi, M.; Kawamoto, Y.; Okamoto, H.; Kimura, M. J. Org. Chem., 2005, 70, 3425. 9. Burke, M. D.; Berger, E. M.; Schreiber, S. L. J. Am. Chem. Soc., 2004, 126, 14095. 10. Winkler, J. D.; Oh, K.; Asselin, S. M. Org. Lett., 2005, 7, 387. 11. Catino, A. J.; Nichols, J. M.; Forslund, R. E.; Doyle, M. P. Org. Lett., 2005, 7, 2787. 12. Thomas, K. R. J.; Thompson, A. L.; Sivakumar, A. V.; Bardeen, C. J.; Thayumanavan, S. J. Am. Chem. Soc., 2005, 127, 373. 13.参考书:现代有机合成试剂<性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无



 沪公网安备 31010602001115号
沪公网安备 31010602001115号