| 物竞编号 | 03J8 |
|---|---|
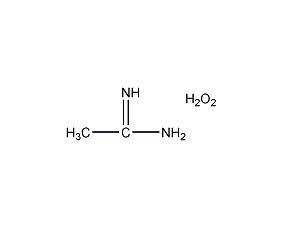
| 分子式 | CH6N2O3 |
| 分子量 | 94.07 |
| 标签 | Carbamide perhydrate, Carbamide-Peroxide, Urea hydrogen peroxide adduct, UHP, Percarbamide, 脂肪族化合物 |
编号系统
CAS号:124-43-6
MDL号:MFCD00013119
EINECS号:204-701-4
RTECS号:暂无
BRN号:3680414
PubChem号:暂无
物性数据
1.性状:白色结晶
2.熔点(℃):90~93
3.溶解性:易溶于水、乙醇、乙二醇和二氯甲烷等有机溶剂中。
毒理学数据
暂无
生态学数据
暂无
分子结构数据
暂无
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:4
3.氢键受体数量:3
4.可旋转化学键数量:0
5.互变异构体数量:2
6.拓扑分子极性表面积110
7.重原子数量:6
8.表面电荷:0
9.复杂度:29
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:2
性质与稳定性
1.基本性质:水溶液兼有尿素和双氧水的性质,在水中能缓慢放出氧气。与过碳酸钠等无机过氧化物相比,其性能更优越,具有活性氧含量高、在水中溶解度大、稳定性好、可溶于有机溶剂等优点。
2.潮湿的试剂在40 oC以上会分解出水和氧气,有腐蚀性和氧化性,建议在干燥阴凉处存储。
贮存方法
贮存于干燥、洁净、通风良好、室温15℃~25℃的仓库内。远离火种、热源和避免阳光直射,注意防潮和雨淋。
合成方法
1. 有湿法工艺和干法工艺两种,干法工艺要求的双氧水浓度较高(85(wt)%左右), 且存在设备复杂、技术条件苛刻、能耗高、产品稳定性差等缺点。大多数过碳酰胺的制备采用湿法工艺,即采用低浓度的双氧水与饱和或过饱和的尿素溶液反应,添加一定量的稳定剂并控制反应温度经过滤、干燥得产品,母液循环使用。
2. 通过尿素在30% 的过氧化氢水溶液中重结晶来制备[1]。
用途
1. 在医药和制药工业上,过氧化尿素可用作一种高效、安全、方便的固体消毒剂,亦可用水溶液。与双氧水、过氧乙酸比较具有明显的杀菌力强、杀菌谱广,使用浓度低,不留残毒等优点,还可抑制细菌与霉菌生长,残留无刺激。在癌症治疗中用于抗肝腹水等。在日化工业中:过氧化尿素可用作人及动物毛发的漂白剂、拉直剂、烫发、染发的中和剂,特别是在牙膏中添加后,能起到一般牙膏所起不到的作用:减少牙斑和细菌,减少牙周疾病和龋齿。同时能使牙齿釉质变硬,对龋齿产生很强的抑制作用。此外,过氧化尿素可以作为漂白剂应用于中性洗涤剂。在农业和养殖业中:过氧化尿素在水产养殖业中可用于鱼塘增氧剂、消毒剂和翻塘缺氧时的急救剂。还可作小家禽饲料消毒供氧剂。还可用作水果、蔬菜的富氧催熟剂。在纺织造纸工业中:过氧化尿素可用于棉花、羊毛、人造丝、亚麻纤维的漂白剂。聚酰胺纤维的柔软剂、抗静电剂和脱色剂。还用于造纸业作漂白剂,矿石浮选改良剂等。
2. 尿素过氧化氢复合物 (UHP) 是由尿素和过氧化氢间的强氢键作用产生的配合物。它将不稳定的过氧化氢转变为易操作、安全的、稳定于室温的固体,且价格低廉。UHP在不同的溶剂和催化剂下显示出不同的氧化能力,是有机合成中一种重要的氧化试剂。最近发表的一篇论文对UHP在合成中的应用做了简单的介绍[2]。
UHP具有过氧化氢的性质,常用于双键的环氧化反应,并具有高度的区域和立体选择性以及较高的转化率。UHP与酸酐联用 (例如:乙酸酐、马来酸酐),可以原位生成有机过氧酸,这种方法可以代替使用高浓度的有机过氧酸。对于α,β-不饱和酮和苯醌的环氧化反应,一般需要碱的催化,如K2CO3[3]。UHP与甲基三氧化铼 (MTO) 联用,使得烯烃的环氧化反应具有优秀的区域和立体选择性 (式1)[4]。对于α,β-不饱和醛的不对称氧化,UHP显示了较其它氧化剂更好的立体选择性和转化率 (式2)[5]。
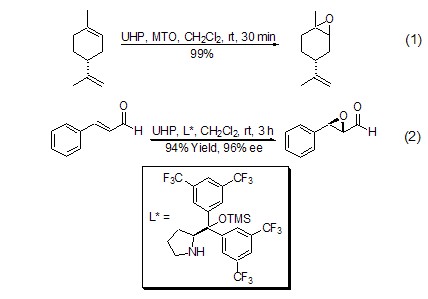
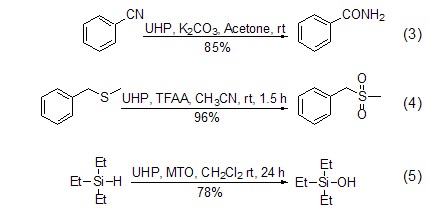
由于UHP的氧化性能可以方便地进行调控,所以可以用于多种官能团的转化,例如:将氰基转化成为酰胺,肟成为硝基,醛成为酸等 (式3,式4)[6]。UHP的另一个重要用途是对 N、S、P、I[2,6]和Si (式5)[7] 等杂原子的氧化反应,在多数情况下其选择性要好于过氧化氢水溶液。
UHP同有机过酸一样,也可以完成Baeyer-Villiger重排反应,而且具有较高的立体选择性 (式6)[8]。

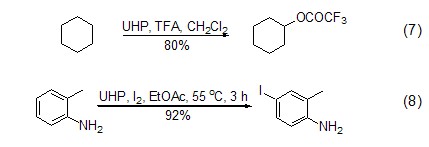
近期文献报道,UHP还可以实现对于非活性C-H键的氧化,形成羟基或酯基(式7)[9];UHP与I2联用可以方便有效地实现对芳基的碘化 (式8)[10]。
安全信息
危险运输编码:UN 1511 5.1/PG 3
危险品标志: 氧化剂
氧化剂  危害环境
危害环境
安全标识:S17 S26 S45 S36/S37/S39
文献
1. Lu, C.-S.; Hughes, E. W.; Giguère, P. A. J. Am. Chem. Soc., 1941, 63, 1507. 2. Taliansky, S. Synlett, 2005, 12, 1962. 3. Fan, C. L.; Lee, W. D.; Teng, N. W.; Sun, Y. C.; Chen, K. J. Org. Chem., 2003, 68, 9816. 4. Spilling, C. D.; Borhlow, T. R. Tetrahedron Lett., 1996, 37, 2717. 5. Marigo, M.; Jranzén, J.; Toulsen, T. B.; Whuang, W.; Jorgensen, K. A. J. Am. Chem. Soc., 2005, 127, 6964. 6. Varma, R. S.; Naicker, K. P. Org. Lett., 1999, 1, 189. 7. Adam, W.; Mitchell, C. M.; Saha-Moller, C. R.; Weichold, O. J. Am. Chem. Soc., 1999, 121, 2097. 8. Katsuki, T.; Irie, R.; Uchida, T.; Watanabe, A. Proc. Natl.Acad. Sci. U. S. A., 2004, 101, 5737 9. Moody, C. J.; O’Connell, J. L. Chem. Commun., 2000, 1311. 10. Lulinski, P.; Kryska, A.; Sosnowski, M.; Skulski, L. Synthesis, 2004, 441. 11.参考书:现代有机合成试剂<性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无




 沪公网安备 31010602001115号
沪公网安备 31010602001115号