| 物竞编号 | 0JRQ |
|---|---|
| 分子式 | SeO2 |
| 分子量 | 110.96 |
| 标签 | 亚硒酐;氧化硒;无水亚硒酸, 亚硒酸酐, Selenious acid anhydride, Selenium dioxide, 氧化剂, 催化剂 |
编号系统
CAS号:7446-08-4
MDL号:MFCD00134090
EINECS号:231-194-7
RTECS号:暂无
BRN号:暂无
PubChem号:24845371
物性数据
1. 性状:白色固体
2. 密度(g/mL,25/4℃): 4.81
3. 相对蒸汽密度(g/mL,空气=1):3.950
4. 熔点(ºC):340
5. 沸点(ºC,常压):684.9
6. 沸点(ºC,5.2kPa): 315-317
7. 折射率: 无可用
8. 闪点(ºC): 无可用
9. 比旋光度(º):无可用
10. 自燃点或引燃温度(ºC):无可用
11. 蒸气压(kPa,25ºC):1 mm Hg ( 157 °C)
12. 饱和蒸气压(kPa,60ºC):无可用
13. 燃烧热(KJ/mol):无可用
14. 临界温度(ºC):无可用
15. 临界压力(KPa):无可用
16. 油水(辛醇/水)分配系数的对数值:无可用
17. 爆炸上限(%,V/V):无可用
18. 爆炸下限(%,V/V): 无可用
19. 溶解性:溶于H2O和极性有机溶剂,经常在HOAc、CH2Cl2和1,4-二氧杂环己烷中使用。
毒理学数据
1 。
试验方法:口服
摄入剂量: 780 ug/kg/26W-I
测试对象:哺乳动物-国内
毒性类型: MutipleDose
毒性作用: 1.肝脏 -肝炎(肝细胞坏死) ,弥漫性
2.肾 ,输尿管,膀胱-改变管(包括急性肾功能衰竭,急性肾小管坏死)
3.慢性数据-死亡
2 。
试验方法:口服
摄入剂量: 68100微克/千克
测试对象:啮齿动物-鼠
毒性类型:急性
毒性作用: 1.嗜睡(普通抑郁活动)
2.惊厥或癫痫阈值的影响
与三氧化二砷的毒性相似。急性中毒时,上呼吸道和眼黏膜出现刺激症状,有干咳、鼻炎、鼻内剧烈灼痛等症,还可引起全身虚弱、头痛、眩晕、恶心、呕吐、呼出的气和皮肤有大蒜味、意识丧失、虚脱。慢性中毒会出现牙釉质改变、皮肤黄染、慢性关节炎、皮疹、指甲病变、贫血、胃肠疾患、神经失调甚至痴呆等。皮肤或黏膜与本品接触发生剧痛、麻木,或引起烧伤。
生态学数据
该物质对环境可能有危害,对水体应给予特别注意。有强烈刺激性。
分子结构数据
1、 摩尔折射率:无可用
2、 摩尔体积(cm3/mol): 无可用
3、 等张比容(90.2K):无可用
4、 表面张力(dyne/cm):无可用
5、 极化率:无可用
计算化学数据
1、 疏水参数计算参考值(XlogP):无可用
2、 氢键供体数量:0
3、 氢键受体数量:2
4、 可旋转化学键数量:0
5、 拓扑分子极性表面积(TPSA):34.1
6、 重原子数量:3
7、 表面电荷:0
8、 复杂度:18.3
9、 同位素原子数量:0
10、 确定原子立构中心数量:0
11、 不确定原子立构中心数量:0
12、 确定化学键立构中心数量:0
13、 不确定化学键立构中心数量:0
14、 共价键单元数量:1
性质与稳定性
2. 易被还原成硒。
3.操作时使用防护用品。注意经常检查空气中硒的浓度。定期检查身体。供给富于蛋白质和氨基酸的膳食。
4.对空气和湿气稳定。由于具有剧毒,建议在通风橱中小心操作和使用。
贮存方法
1.贮存在通风、干燥的库房中。注意防潮,包装应密封。要防止包装破损。
合成方法
1.硒粉氧化法将硒粉和氧气在二氧化氮的存在下进行反应,生成物经冷却,得到成品,再经升华制得纯的二氧化硒。其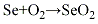
2.硝酸氧化法将粗硒粉加到反应器中与硝酸进行反应,生成物经浓缩、过滤、干燥,再加热分解,制得二氧化硒。其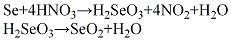
用途
1.用于制高纯硒和其他硒化合物,还是有机合成药物的氧化剂和催化剂;用作植物碱之特殊试剂,还可用于沉淀锆、铪和制备硒化合物。用作电镀中的添加剂。
2.用作有机化合物氧化剂、催化剂、化学试剂,各种无机硒化合物制造的原料。也在复印机、整流器等中使用。
3.二氧化硒在有机合成中主要被定义为氧化试剂,它参与的氧化反应有很多。可能由于该试剂毒性的原因,近些年来,许多反应逐渐被其它更优秀的试剂所取代。但是,二氧化硒与活性甲基、亚甲基和次甲基的氧化反应仍然在有机化学官能团转换中起到重要的作用。
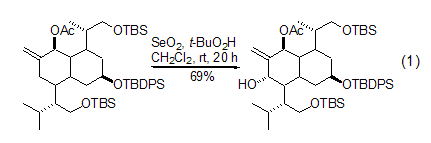
二氧化硒对烯键致活的烯丙基位的氧化羟基化反应最具特色[1~4]。如果使用t-BuOOH作为共氧化剂的话,二氧化硒不仅可以减少到催化量,而且反应的条件也温和许多[2~4]。多数情况下,该反应在CH2Cl2溶剂中室温下放置搅拌数小时或者数天即可完成 (式1)。
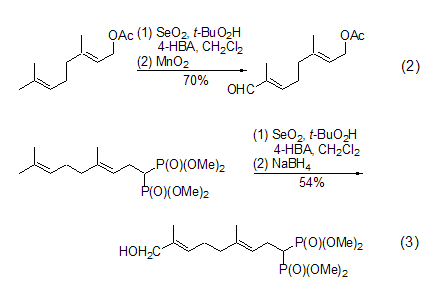
虽然早期研究显示,二氧化硒单独对烯丙基位氧化的活性次序是CH2 > CH3 > CH[5],但在SeO2-t-BuOOH体系中并非如此。许多时候,末端甲基可能是最先被氧化的对象,而且产物往往是生成醇和醛的混合物。所以,该反应可以与另一个氧化反应[6]或者还原反应[7]连续使用,得到单一的醛或者单一的醇 (式2,式3)。
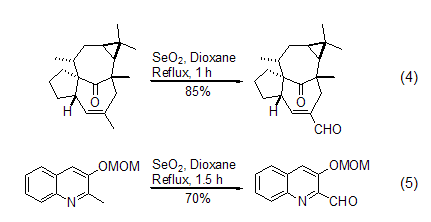
在升温条件下或者回流条件下,二氧化硒的氧化能力得到明显的提高。可以将酮羰基 α-位的甲基或者烯丙基位的甲基直接氧化成醛[8]。该反应在吡啶或者吡啶衍生物的反应中特别有意义,因为在此条件下吡啶环不受到明显的影响 (式4,式5)[9,10]。
安全信息
危险运输编码:暂无
危险品标志:暂无
安全标识:暂无
危险标识:暂无
文献
1. Aslaoui, J.; Li, H.; Morin, C. Tetrahedron Lett., 2005, 46, 1713. 2. Paquette, L. A.; Efremov, I.; Liu, Z. J. Org. Chem., 2005, 70, 505. 3. Thunuguntla, S. S. R.; Nyavanandi, V. K.; Nanduri, S. Tetrahedron Lett., 2004, 45, 9357. 4. Bravo, F.; McDonald, F. E.; Neiwert, W. A.; Hardcastle, K. I. Org. Lett., 2004, 6, 4487. 5. Kim, M.; Kleckley, T. S.; Wiemer, A. J.; Holstein, S A.; Hohl, R. J.; Wiemer, D. F. J. Org. Chem., 2004, 69, 8186. 6. Shull, L.W.; Wiemer, D. F. J. Organomet. Chem., 2005, 690, 2521. 7. Rapoport, H., Bhalerao, U. T. J. Am. Chem. Soc., 1971, 93, 4835. 8. Watanabe, K.; Suzuki, Y.; Aoki, K.; Sakakura, A.; Suenaga, K.; Kigoshi, H.; J. Org. Chem., 2004, 69, 7802. 9. Riego, E.; Bayo, Nuria; C., Carmen; A., F.; Alvarez, M. Tetrahedron, 2005, 61, 1407. 10. Heimgaertner, G.; Raatz, D.; Reiser, O. Tetrahedron, 2005, 61, 643. 11.参考书:现代有机合成试剂<性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
暂无




 沪公网安备 31010602001115号
沪公网安备 31010602001115号