| 物竞编号 | 098A |
|---|---|
| 分子式 | Al2O3 |
| 分子量 | 101.96 |
| 标签 | 三氧化二铝, 铝氧, Alumina, γ-Alumina, 脱水吸附剂, 催化剂, 胶黏剂, 抛光剂, 研磨剂, 陶瓷封装用材料 |
编号系统
CAS号:1344-28-1
MDL号:MFCD00003424
EINECS号:215-691-6
RTECS号:BD1200000
BRN号:暂无
PubChem号:暂无
物性数据
1. 性状:白色粉末
2. 密度(g/mL,25/4℃):3.5-3.9
3. 相对蒸汽密度(g/mL,空气=1):未确定
4. 熔点(ºC):2045
5. 沸点(ºC,常压):未确定
6. 沸点(ºC,5.2kPa):2980
7. 折射率:未确定
8. 闪点(ºC):未确定
9. 比旋光度(º):未确定
10. 自燃点或引燃温度(ºC):未确定
11. 蒸气压(kPa,25ºC):未确定
12. 饱和蒸气压(kPa,60ºC):未确定
13. 燃烧热(KJ/mol):未确定
14. 临界温度(ºC):未确定
15. 临界压力(KPa):未确定
16. 油水(辛醇/水)分配系数的对数值:未确定
17. 爆炸上限(%,V/V):未确定
18. 爆炸下限(%,V/V):未确定
19. 溶解性:不溶于水、醇、和醚,微溶于碱和酸。
毒理学数据
主要的刺激性影响:
在皮肤上面:可能引起发炎。
在眼睛上面:可能引起发炎
致敏作用:没有已知的敏化作用。
生态学数据
对是水稍微有危害的不要让未稀释或大量的产品接触地下水、水道或者污水系统,若无政府许可,勿将材料排入周围环境。
分子结构数据
1、摩尔折射率:无可用的
2、摩尔体积(cm3/mol):无可用的
3、等张比容(90.2K):无可用的
4、表面张力(dyne/cm):无可用的
5、介电常数:无可用的
6、极化率(10-24cm3):无可用的
7、单一同位素质量:101.94782 Da
8、标称质量:102 Da
9、平均质量:101.9613 Da
计算化学数据
1、 氢键供体数量:0
2、 氢键受体数量:3
3、 可旋转化学键数量:0
4、 拓扑分子极性表面积(TPSA):43.4
5、 重原子数量:5
6、 表面电荷:0
7、 复杂度:34.2
8、 同位素原子数量:0
9、 确定原子立构中心数量:0
10、 不确定原子立构中心数量:0
11、 确定化学键立构中心数量:0
12、 不确定化学键立构中心数量:0
13、 共价键单元数量:1
性质与稳定性
1.如果遵照规格使用和储存则不会分解,未有已知危险反应,避免氧化物。
2.用氧化铝纤维强化金属时,与金属的溶合性良好。另外,对金属不引起化学反应,是理想的金属强化纤维。氧化铝纤维是多晶耐火纤维的一个重要品种。氧化铝纤维导热率、加热收缩率和热容量都较低。具有耐高温、高热的特性,长期使用温度为1300~1400℃,高于普通硅酸铝纤维(1000~1100℃),其最高使用温度为1500~1700℃。与碳纤维、碳化硅纤维等非氧化物纤维相比,氧化铝纤维不仅具有高强度、高模量、耐高温等优良性能,而且还有很好的高温抗氧化性、耐腐蚀性和电绝缘性。可在酸性环境、氧化气氛、还原气氛和真空条件下使用,对碱性环境也有一定耐蚀性,但易受铅蒸气和五氧化二钒的侵蚀。
3.易吸水但不潮解。为两性化合物。
4.能够导致呼吸困难,最好在通风橱中进行操作,在干燥和惰性条件下存储。
贮存方法
应贮存于干燥、通风库房中,严防受潮。
合成方法
(1)其制备方法有酸法,碱法和醇铝法三种。目前国内主要采用碱法,少数厂家采用醇铝法。
酸法将硫酸铝配成6%的水溶液,加入中和槽中,再将液氨配成15%~20%的氨水,按计算量将氨水快速加入,在强烈搅拌下于室温反应40~60 min,至pH值达到8~9左右时,反应基本完成。将生成的沉淀物经压滤、用无离子水洗涤除去杂质离子,洗涤水中一般加少量氨水调节pH值为8~9,以防洗涤过程中氢氧化铝发生胶凝过程而引起物料损失。将洗涤过的沉淀物加入少量33%的硝酸溶液,在强烈搅拌下生成胶状料浆(此过程称为打浆)。再经喷雾干燥,将得到的微球形氢氧化铝挤条成型,在550℃下焙烧活化4h,即脱水形成活性氧化铝。其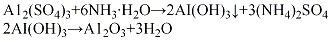
(2)碱法把工业固体烧碱加水配成浓度为600 g/L的烧碱溶液,在50~80℃下加入氢氧化铝后升温至110℃,保温3 h进行反应,将所得溶液用水稀释至含氧化铝为100g/L,静置0.5~1h,经过滤,除去氢氧化铁等不溶性杂质,再将清液和20%硝酸溶液按照一定比例进行中和反应,温度控制在30~50℃下,控制pH 7~7.5,反应10 min 左右以后,再将反应液在常温搅拌下老化2h,经过滤、用无离子水多次洗涤、于110℃烘干、挤条成型、干燥、500℃活化4h,制得活性氧化铝。其
(3)醇铝法将金属铝片加入异丙醇溶液中进行反应,生成异丙醇铝,通过水蒸气鼓泡(入口温度180℃,水解温度175℃),使异丙醇铝水解,生成水合氧化铝,经熟化、过滤、于100℃干燥、500℃脱水活化,制得活性氧化铝。其
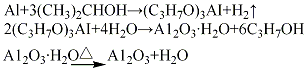
(4)高温快脱法:将氢氧化铝(水合氧化铝)经高温快速脱水、成型、水热处理及干燥后制得成品。
(5)炭化铝胶法:将氢氧化铝和氢氧化钠混合,再经中和、二氧化碳碳化、水洗、压滤、干燥、粉碎、捏合、挤条、干燥、煅烧等过程制得成品。
(6)喷雾干燥法:将氢氧化铝与工业硫酸反应,再经碱液中和、水洗、喷雾干燥、煅烧等过程制得成品。
(7)油柱成型法:将铝锭用工业盐酸溶解,再经油柱成球、水洗、干燥、煅烧等过程制得成品。
制备过程中各种条件,特别是沉淀条件对产品的晶型、表面积、孔结构等影响很大,一般地,低温、低 pH 值下易得到无定形氢氧化铝及拟薄水铝石,高 pH 值易生成三水铝石。拟薄水铝石在 430~500℃下,煅烧得到γ-Al2O3,β三水铝石在 300℃煅烧得到 η-Al2O3。
图XIII-14 氢氧化铝的脱水途径
(8)高纯铵明矾热解法以硫酸铝、硫酸铵为原料合成铵明矾(硫酸铝铵),经脱水、热解生成氧化铝,再经转相制得γ-,α-氧化铝。
利用有机铝化合物聚合生成黏稠的聚铝氧烷溶液,将聚铝氧烷溶液进行干式纺丝,得到有机铝化合物纤维,再经煅烧制得氧化铝纤维。
使有机铝化合物聚合,生成黏稠的聚铝氧烷溶液,将其利用普通的干式纺丝法,制成有机铝化合物纤维。再经煅烧制得氧化铝纤维。
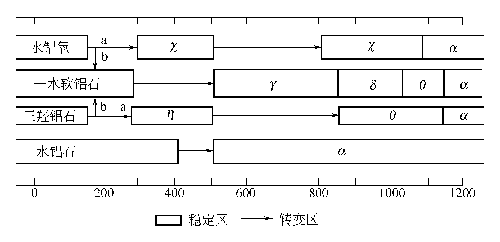
9.制法 方法1.用蒸馏水溶解结晶硫酸铝,然后在不断搅拌下慢慢加入硫酸铵溶液,制得硫酸铝铵:
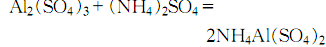
然后加热至100~200℃,除去结晶水后,研成粉末进行高温灼烧,开始在800℃ 灼烧,然后升温至1250~1300℃灼烧4h,冷却后即得氧化铝:
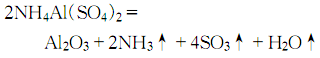
用途
1.用作催化剂和催化剂载体,是石油炼制和石油化工中主要的催化剂和载体。还用作空气及其他气体的脱湿剂,变压器油和透平油的脱酸剂。
2.用于锻造的加热炉、均热炉等工业用的高温炉。可作密封材料和填充材料。还可作强化用补强纤维,窑炉的炉衬,电子元件(IC板、铁氧体)的煅烧炉等。
3.氧化铝纤维主要用于高温绝热材料和增强复合材料。氧化铝短纤维具有突出的耐高温性能,可与树脂、金属或陶瓷进行复合制备高性能复合材料,制造加热炉、窑炉衬里及电子元件煅烧炉等工业用高温炉。由于其密度小。绝热性好、热容量小,不仅可以减轻炉体质量,而且可以提高控温精度,节能效果显著。氧化铝纤维在高温炉中的节能效果比一般的耐火砖或高温涂料好。将其用于增强金属时,与金属完全不起化学作用,耐腐蚀性好,因此氧化铝纤维是金属的增强纤维。还可用于编织无纺布、编织带、绳索等各种形状的纤维制品。
4.用于制造加热炉、均热炉等工业用高温炉。用作密封材料、填充材料、FRM用增强纤维、窑炉衬里及电子元件(IC基板、铁氧体)煅烧炉等。
5.主要用作化纤纤维填料,也用于化妆品磨面膏的磨面剂、牙膏摩擦剂及冶金和化学品中。
6.分析试剂,有机溶剂的脱水吸附剂,研磨剂,低熔点铅玻璃的配制。
7.氧化铝是色谱中最常用的一种填充材料,有酸性、碱性和中性。是一种能进行催化脱水、消除、加成、缩合、环氧化物开环、氧化和还原反应的试剂,对于均相反应来说反应条件通常更温和、更具有选择性[1]。
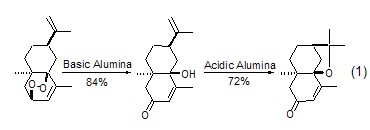
加成与缩合反应 无论是亲电反应还是亲核反应,氧化铝都可促进各类杂原子的加成反应。氧化铝也能使羟基和烷氧基发生分子内加成生成相应的烯烃 (式1)[2]。
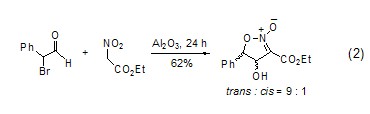
在氧化铝的作用下,醛和不同活性的亚甲基化合物之间的醇醛缩合反应、Michael反应和Wittig反应常在无溶剂、温和的条件下进行。硝基醇醛环化生成2-异唑啉的2-氧化物的反应具有很好的立体选择性 (式2)[3]。
氧化铝有利于Diels-Alder反应、烯烃反应和Carroll重排等受轨道对称性控制的反应。这些反应条件温和且有很高的立体选择性。
在Al2O3的作用下,S可与环氧丙烷更易进行亲核加成反应,而后脱水形成烯 (式3)[4]。
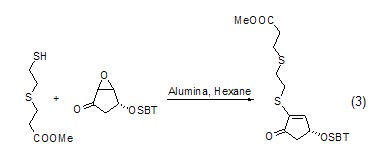
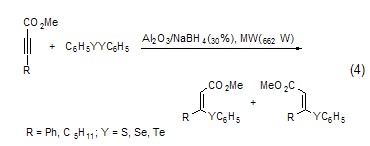
以氧化铝为固相载体微波照射后反应物中的S、Se和Te可以与炔进行亲核加成,产物为α,β-不饱和酯 (式4)[5]。
环氧化反应 在温和的、选择性的条件下,用醇、硫醇、硒醇、胺、羧酸和过氧化物等亲核试剂可以使环氧化物发生开环反应。这种方法可用于顺烯胺的合成 (式5)[6]。

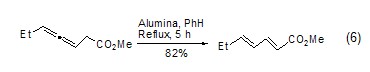
氧化铝可催化许多重排反应。活性的氧化铝使O-磺酰肟发生Beckmann重排生成预期的酰胺,而碱性的氧化铝生成相应的唑啉。在氧化铝作用下,β,γ-不饱和酮可异构化为共轭酮、炔烃异构化成烯烃、烯烃异构化成共轭双烯醇化 (式6)[7]。
氧化铝可促进伯醇乙酸酯水解作用、酰亚胺的脱酰作用、磺酰肟的水解作用和β-酮酸酯和氨基甲酸盐的脱烷氧羰基化作用[8]。
安全信息
危险运输编码:暂无
危险品标志:暂无
安全标识:暂无
危险标识:暂无
文献
1. Posner, G. H. Angew. Chem., Int. Ed., 1978, 17, 487. 2. McPhail, A. T.; Onan, K. D. Tetrahedron Lett., 1973, 4641. 3. Rosini, G.; Galarini, R.; Marotta, E.; Righi, E. P. J. Org. Chem., 1990, 55, 781. 4. Maruyama, T.; Asada, M.; Shiraishi, T.; Egashira, H.; Yoshida, H.; Maruyama, T.; Ohuchida, S.; Nakai, H.; Kondo, K.; Toda, M. Bio. Med. Chem., 2002, 10, 975. 5. Perin, G.; Jacob, R. G.; de Azambuja, F.; Botteselle, G. V.; Siqueira, G.M.; Freitag, R. A.; Lenardao, E. J. Tetrahedron Lett., 2005, 46, 1679. 6. Hudrlik, P. F.; Hudrlik, A. M.; Kulkarni, A. K. Tetrahedron Lett., 1985, 26, 139. 7. Tsuboi, S.; Matsuda, T.; Mimura, S.; Takeda, A. Org. Synth.Chem., 1993, 8, 251. 8. (a) Greene, A. E.; Crabbé, P. Tetrahedron Lett., 1976, 2707. (b) van Leusen, A. M.; Strating, J. Org. Synth. Chem., 1988, 6, 981. 9.参考书:现代有机合成试剂<性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7
备注
曾用CAS:1302-74-5





 沪公网安备 31010602001115号
沪公网安备 31010602001115号