| 物竞编号 | 0NDH |
|---|---|
| 分子式 | LiAlH4 |
| 分子量 | 37.95 |
| 标签 | 四氢化铝锂, LAH, Lithium alanate, Lithium tetrahydroaluminate, 还原剂 |
编号系统
CAS号:16853-85-3
MDL号:MFCD00011075
EINECS号:240-877-9
RTECS号:BD0100000
BRN号:暂无
PubChem号:24882214
物性数据
1.性状:白色疏松的结晶块或粉末,有吸湿性,放置时变成灰色。[8]
2.熔点(℃):>125(分解)[9]
3.相对密度(水=1):0.92[10]
4.溶解性:不溶于烃类,溶于乙醚、四氢呋喃。[11]
毒理学数据
1.急性毒性[12] LC50:85mg/m3(小鼠吸入)
2.刺激性 暂无资料
生态学数据
通常对水体是稍微有害的,不要将未稀释或大量产品接触地下水,水道或污水系统,未经政府许可勿将材料排入周围环境。
分子结构数据
暂无
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:0
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积0
7.重原子数量:2
8.表面电荷:0
9.复杂度:0
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:6
性质与稳定性
1.容易吸潮分解,室温时在干燥空气中稳定。其乙醚溶液可作还原剂或氢化剂。
2.氢化铝锂的固体和溶液都具有高度可燃性,必须隔绝空气、湿气,并最好在氮气氛下保存。
3.稳定性[13] 稳定
4.禁配物[14] 强氧化剂、酸类、醇类、水
5.避免接触的条件[15] 潮湿空气、受热
6.聚合危害[16] 不聚合
7.分解产物[17] 金属铝、氢气
贮存方法
储存注意事项[18] 储存于阴凉、干燥、通风良好的专用库房内,远离火种、热源。库温不超过32℃,相对湿度不超过75%。包装密封。应与氧化剂、酸类、醇类等分开存放,切忌混储。储区应备有合适的材料收容泄漏物。
合成方法
1.用氢化锂为原料与三氯化铝或三溴化铝在乙醚溶液中作用,可制得氢化铝锂。
预先粉碎氢化锂;在N2气氛围中将块状的氢化锂粉碎成细小颗粒,并过筛。颗粒大小决定反应的难易。
乙醚的干燥:所用的乙醚须绝对干燥并且不含过氧乙醚。用CaCl2和金属钠来干燥还显不够,应用NaOH或CaH2脱水,然后进行蒸馏以除去水分和过氧乙醚。
氢化铝锂的制备:取三口烧瓶、滴液漏斗、回流冷凝器、搅拌棒等进行干燥后备用。并注意切莫使AlCl3吸潮。
在三口烧瓶中加入23.5g(2.96mol)的LiH和200mL乙醚制成悬浊液,在强烈的搅拌下滴加入71.2g(0.534mol)的三氯化铝乙醚溶液300mL。乙醚呈现沸腾状说明反应开始。调节滴加速度控制反应平稳的进行。AlCl3滴加完毕后,继续搅拌直至反应终止,静置片刻。用N2气将烧瓶中的反应物压出,使经过一个玻璃砂芯漏斗过滤,将澄清的滤液蒸发至黏稠状,残余的乙醚在减压下70℃除去,剩余物即为氢化铝锂。收率约85%。
如果滴加AlCl3时未发生反应,或者反应以后又停下来,表明LiH粉碎得细度不够。遇以上情况可在烧瓶中加30mL LiAlH4(3g)的乙醚溶液作为引发剂,以避免反应因延缓可能导致的突发式的爆炸反应。
若以AlBr3代替AlCl3,LiH的颗粒可不必太细,可以似黄豆大小,不致影响反应的进行。操作步骤类似于使用AlCl3。加完AlBr3可加热至乙醚沸腾的温度,冷却后过滤即得LiAlH4的乙醚溶液。
用途
1.羰基试剂。还原剂。制造其他氢化物及硅烷、硼烷等。在医药、香料、农药、染料及其他精细有机合成中用作还原剂。可将醛酮、酸、酸酐、酯、醌、酰氯等还原为醇,将腈还原为伯胺,将卤化烃还原为烃,芳香硝基化合物还原成偶氮化合物。但通常不能使碳—碳双键氢化。100份乙醚能溶本品30份,100份四氢呋喃能溶13份,100份二甲基溶纤剂能溶10份,100份二丁醚能溶2份,100份二氧六环能溶0.1份。
2.氢化铝锂是有机化学中一个常用的还原试剂,能够还原多种官能团化合物;同时也能作用于双键和三键化合物实现氢铝化反应;氢化铝锂也能作为碱参与反应。
氢化铝锂具有很强的氢转移能力,能够将醛、酮、酯、内酯、羧酸、酸酐和环氧化物还原为醇,或者将酰胺、亚胺离子、腈和脂肪族硝基化合物转换为对应的胺。此外,氢化铝锂超强的还原能力使得可以作用于其它官能团,如将卤代烷烃还原为烷烃 (式1)[1]。该类反应中,卤代物的活性从大到小依次是碘代物、溴代物和氯代物。
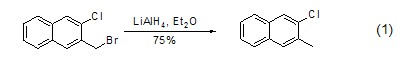
通常氢化铝锂对醚类化合物无反应活性,但也有例外,如将邻酯衍生物高产率地转换为羧醛 (式2)[2]。
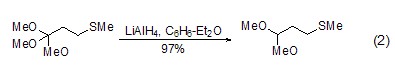
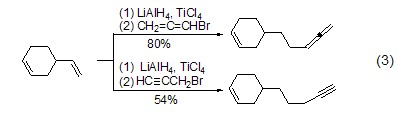
氢化铝锂能够对烯烃发生氢铝化反应,得到Al-C键中间体,进而能够与其它亲核试剂如卤代物反应,实现烯烃的加成反应 (式3)[3]。该类反应通常需要加入路易斯酸如四氯化碳或氯化镍,才能获得较好的反应活性。
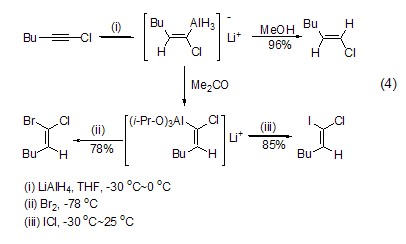
同样,氢化铝锂也能对炔烃发生氢铝化反应,得到sp2-C-Al键中间体,进而与质子、溴和碘正离子反应得到相应的官能化烯烃产物 (式4)[4]。
当烯烃或炔烃底物含有邻位羟基时,氢化铝锂能够单独诱导实现氢铝化反应 (式5)[5]。这是因为铝有很强的亲氧性,在反应中能够形成稳定的铝-氧键成环状中间体,从而利于氢转移反应的发生。

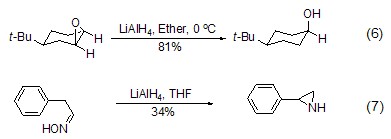
环氧化合物在氢化铝锂作用下能够发生还原断裂反应,得到相应的开环产物 (式6)[6]。该类反应中,负氢离子通常进攻空间位阻较小的碳端。肟在氢化铝锂的作用下,则能通过氢还原发生闭环反应,得到氮杂环丙烷产物 (式7)[7]。
3.用作聚合催化剂、还原剂、喷气发动机燃料,也用于合成药物。[19]
安全信息
危险运输编码:暂无
危险品标志: 很易燃
很易燃  极易燃
极易燃  有害
有害  刺激
刺激  腐蚀
腐蚀
安全标识:S43
危险标识:R10 R11 R12 R15 R19 R22 R34 R40 R66 R67 R36/37 R14/15
文献
1. Karabatsos, G. J.; Shone, R. L. J. Org. Chem., 1968, 33, 619. 2. Claus, C. J.; Morgenthau, J. L. J. Am. Chem. Soc., 1951, 73, 5005. 3. (a) Sato, F.; Kodama, H.; Sato, M.; Chem. Lett., 1978, 789. (b) Sato, F.; Ogura, K.; Sato, M. Chem. Lett., 1978, 805. 4. Zweifel, G.; Lewis, W.; On, H. P. J. Am. Chem. Soc., 1979, 101, 5101. 5. Keck, G. E.; Webb, R. R. Tetrahdron Lett., 1982, 23, 3051. 6. Rickborn, B.; Quartucci, J. J. Org. Chem., 1984, 29, 3185. 7. Kotera, K.; Kitahonoki, K. Tetrahedron Lett., 1965, 1059. [1~7]参考书:现代有机合成试剂<性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7 [8~19]参考书:危险化学品安全技术全书.第一卷/张海峰主编.—2版.北京;化学工业出版社,2007.6 ISBN 978-7-122-00165-8
备注
暂无




 沪公网安备 31010602001115号
沪公网安备 31010602001115号