| 物竞编号 | 030C |
|---|---|
| 分子式 | C4H4O |
| 分子量 | 68.07 |
| 标签 | 一氧二烯五环, 氧杂茂, Oxol, Divinylene Oxide, 杂环化合物, 中间体, 合成原料 |
编号系统
CAS号:110-00-9
MDL号:MFCD00003222
EINECS号:214-757-1
RTECS号:LT8524000
BRN号:103221
PubChem号:暂无
物性数据
1.性状:无色液体,有温和的香味。[13]
2.熔点(℃):-85.6[14]
3.沸点(℃):31.4[15]
4.相对密度(水=1):0.94[16]
5.相对蒸气密度(空气=1):2.35[17]
6.饱和蒸气压(kPa):65.6(20℃)[18]
7.燃烧热(kJ/mol):-2090.4[19]
8.临界压力(MPa):5.32[20]
9.辛醇/水分配系数:1.34[21]
10.闪点(℃):-35(CC)[22]
11.引燃温度(℃):390[23]
12.爆炸上限(%):14.3[24]
13.爆炸下限(%):2.3[25]
14.溶解性:不溶于水,溶于丙酮、苯,易溶于乙醇、乙醚等多数有机溶剂。[26]
15.折射率(n20ºC):1.4214
16.蒸发热(J/mol,31.2ºC):399.8
17.生成热(KJ/mol):62.0
18.相对密度(20℃,4℃):0.9514
19.临界密度(g·cm-3):0.312
20.临界体积(cm3·mol-1):218
21.临界压缩因子:0.294
22.偏心因子:0.200
23.溶度参数(J·cm-3)0.5:18.541
24.van der Waals面积(cm2·mol-1):4.920×109
25.van der Waals体积(cm3·mol-1):37.580
26.气相标准燃烧热(焓)(kJ·mol-1):-2110.95
27.气相标准声称热(焓)( kJ·mol-1) :-34.73
28.气相标准熵(J·mol-1·K-1) :267.25
29.气相标准生成自由能( kJ·mol-1):0.9
30.气相标准热熔(J·mol-1·K-1):65.40
31.液相标准燃烧热(焓)(kJ·mol-1):-2083.30
32.液相标准声称热(焓)( kJ·mol-1):-62.38
33.液相标准熵(J·mol-1·K-1) :176.95
34.液相标准生成自由能( kJ·mol-1):0.17
35.液相标准热熔(J·mol-1·K-1):114.56
毒理学数据
1.急性毒性[27] LC50:3398ppm(大鼠吸入,1h);120mg/m3(小鼠吸入,1h)
2.刺激性 暂无资料
3.致突变性[28]
微生物致突变:鼠伤寒沙门菌825nmol/皿。DNA修复:枯草杆菌3500μg/皿。哺乳动物体细胞突变:小鼠淋巴细胞1139mg/L。细胞遗传学分析:仓鼠卵巢184mmol/L。
4.致癌性[29] IARC致癌性评论:G2B,可疑人类致癌物。
生态学数据
1.生态毒性[30] LC50:61mg/L(96h)(黑头呆鱼);166mg/L(48h)(青鳉)
2.生物降解性[31]
好氧生物降解(h):168~672
厌氧生物降解(h):672~2688
3.非生物降解性[32]
水中光氧化半衰期(h):13.8~1375
空气中光氧化半衰期(h):0.477~4.72
分子结构数据
1、摩尔折射率:18.55
2、摩尔体积(cm3/mol):72.2
3、等张比容(90.2K):161.2
4、表面张力(dyne/cm):24.8
5、极化率(10-24cm3):7.35
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:1
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积13.1
7.重原子数量:5
8.表面电荷:0
9.复杂度:22.8
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
性质与稳定性
1.呋喃是很好的富电芳香杂环,可与金属形成金属有机化合物参与反应,可发生[2+2]光反应、[2+3]环加成、[4+3]环加成和Diels-Alder反应,也可以发生卡宾反应[1]。
2-卤代、酰基、氰基、磺酰基和羰基呋喃的合成 呋喃作为富电的芳香杂环可以与很多的亲电试剂发生反应,用以制备卤代呋喃、酰基呋喃、氰代呋喃和其它杂原子取代呋喃等产物 (式1)[2]。一般情况下C-2位比C-3位更容易受亲电试剂的进攻。
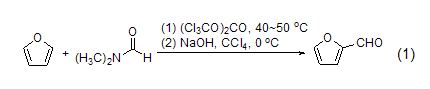
烷基呋喃的合成 烷基呋喃可由呋喃经过亲电取代反应制得。呋喃发生Mannich反应可生成2-(N,N-二烷基氨基)甲基呋喃衍生物,TMSI存在下呋喃也可以与β-酮发生反应。而在Ag+催化下,1,3-二苯基硒丙烷 (式2) 或者氯代环丙烷可与呋喃发生烯丙基化[3]。
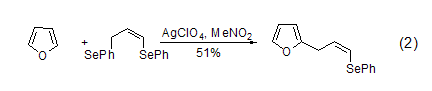
与游离基的反应 呋喃可以和亲电的碳游离基反应得到2-烷基取代的呋喃 (式3)[4]。
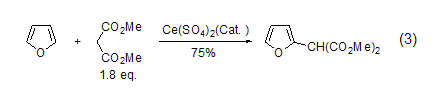
在Pd催化下,带有吸电子基团的溴化物与可以呋喃直接偶合 (式4)[5]。
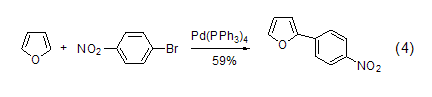
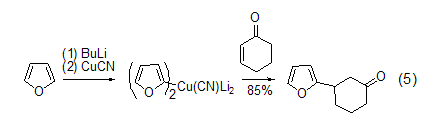
有机金属化合物 呋喃锂盐在有机合成中广泛使用。金属取代的呋喃可以与很多的亲电试剂发生反应,而且2-锂代呋喃也可以发生金属的转移反应。2-取代呋喃的高价铜酸盐可以在低温下与酮发生共轭加成反应 (式5)[6]。
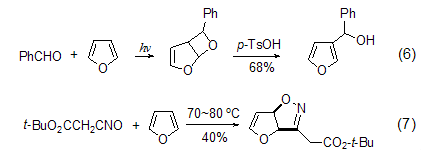
烯的环加成 光照下羰基化合物与呋喃[2+2]环加成生成环醚后,用酸处理可得到3-取代呋喃 (式6)[7]。呋喃与氰氧化物会发生[2+3]环加成 (式7),可用来合成多羟基胺类化合物[8]。
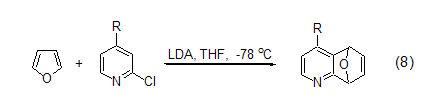
二烯的环加成 呋喃以二烯的形式参与Diels-Alder反应是呋喃在有机合成中最广泛的应用,提供了很多碳碳键的形成方法并可用于后续的合成。但是由于呋喃本身的芳香性,Diels-Alder反应速度都很慢。呋喃不仅能与丙二烯化合物发生Diels-Alder反应得到选择性的产物,而且还能和乙炔类化合物反应。呋喃和不同芳香烯的反应是合成多烯化合物的一种很好方法 (式8)[9]。
呋喃和偶极物质反应得到8-氧-二环[3.2.1]癸-6-烯-3-酮 (式9)[10]。这些[4+3]的环加成产物能很容易地转变成环庚酮、环庚三烯酮以及被取代的环庚烷体系,或是被取代的四氢呋喃化合物。
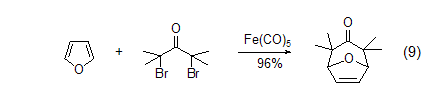
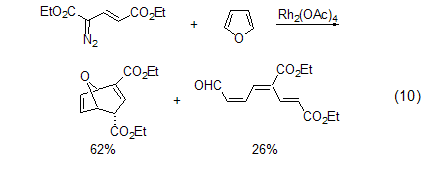
卡宾反应 包括卡宾加成生成2-氧-二环[3.1.0]己-3-烯的反应等。呋喃与乙烯基卡宾反应会得到两种产物 (式10)[11,12]。
2.稳定性[33] 稳定
3.禁配物[34] 强氧化剂、酸类
4.避免接触的条件[35] 空气
5.聚合危害[36] 不聚合
贮存方法
储存注意事项[37] 通常商品加有阻聚剂。储存于阴凉、通风的库房。远离火种、热源。库温不宜超过29℃。避光保存。包装要求密封,不可与空气接触。应与氧化剂、酸类分开存放,切忌混储。采用防爆型照明、通风设施。禁止使用易产生火花的机械设备和工具。储区应备有泄漏应急处理设备和合适的收容材料。
合成方法
1.由糠醛氧化得到2-呋喃甲酸,经脱羧后,即得呋喃。将2-呋喃甲酸加热至200-205℃(沸点左右),即分解为呋喃和二氧化碳。反应过程中,将升华的2-呋喃甲酸返回反应器,馏出的呋喃重新蒸馏,收集31-34℃馏分即得较纯的成品。收率约75%。工业上可由糠醛直接脱羰。反应所用的催化剂有硅酸铝、金属氧化物或氢氧化物以及合金或金属的混合物,如亚铬酸锌和锰的混合物,反应温度约400℃,收率90%。在大规模生产时收率可达74%。
精制方法:用5%氢氧化钾水溶液洗涤,无水硫酸钙或无水硫酸钠干燥,使用前在氢氧化钾或金属钠存在下蒸馏。若有过氧化物,可用硫酸氢钠和弱酸性硫酸亚铁水溶液洗涤除去。
用途
1.用于制取吡咯、噻吩、四氢呋喃等。呋喃经醚化,还原得到2,5-二甲氧基二氢呋喃,经水解生成2-羟基-1,4-丁二醛,可用于合成法山莨菪碱的生产;当呋喃经醚化、还原,再经催化加氢得到2,5-二甲氧基四氢呋喃时,经水解生成丁二醛,则是合成另一种生物碱阿托品的原料。呋喃还用来生产消炎药甲苯酰吡各乙酸钠,每吨这种药物需消耗呋喃4.75t。
2.用于有机合成或用作溶剂。[38]
安全信息
危险运输编码:UN 2811 6.1/PG 2
危险品标志: 易燃
易燃
安全标识:S9 S16 S33 S45 S53 S61 S36/S37/S39
危险标识:R12 R19 R26 R38 R40 R45 R68 R20/22 R48/22 R52/53
文献
1. Dean, F. M. Adv. Heterocycl. Chem., 1982, 30, 167; 1982, 31, 237. 2. Shan, W. G..; Shi, X. J.; Su, W. K. Org. Prep. Proced. Int., 2004, 36(4), 337. 3. Heaney, H.; Papageorgiou, G.; Wilkins, R. F. Tetrahedron Lett., 1988, 29, 2377. 4. Weinstock, L. M.; Corley, E.; Abramosn, N. L.; King, A. O.; Karady, S. Heterocycles, 1988, 27, 2627. 5. Ohta, A.; Akita, Y.; Ohkuwa. T.; Chiba, M.; Fukunaga, R.; Miyafuji, A.; Nakata, T.; Tani, N.; Aoyagi, Y. Heterocycles, 1990, 31, 1951. 6. Ng, J. S.; Behling, J. R.; Campbell, A. L.; Nguyen, D.; Lipshutz. B. Tetrahedron Lett., 1988, 29, 3045. 7. Zamojski, A.; Kozluk, T. J. Org. Chem., 1977, 42, 1089. 8. Jager, V.; Muller, I.; Paulus, E. F. Tetrahedron Lett., 1985, 26, 2997. 9. Connon, S. J.; Hegarty, A. F. Eur. J. Org. Chem., 2004, 16, 3477. 10. Noyori, R. Acc. Chem. Res., 1979, 12, 61. 11. Shono, T.; Matsumura, Y.; Yamane, S. I. Tetrahedron Lett., 1981, 22, 3269. 12. Davies, H. M. L.; Clark, D. M.; Alligood, D. B.; Eiband, G. R. Tetrahedron, 1987, 43, 4265. [1~12]参考书:现代有机合成试剂<性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7 [13~38]参考书:危险化学品安全技术全书.第一卷/张海峰主编.—2版.北京;化学工业出版社,2007.6 ISBN 978-7-122-00165-8
备注
暂无




 沪公网安备 31010602001115号
沪公网安备 31010602001115号