| 物竞编号 | 0JZX |
|---|---|
| 分子式 | SOCl2 |
| 分子量 | 118.98 |
| 标签 | 亚硫酰(二)氯, 亚硫酰氯, 氯化亚砜, 二氯氧硫, 氯化亚硫酰, 亚硫酰二氯, SOCl2, Sulfinyl chloride, Sulfinyl dichloride, 氯化剂, 脱水剂, 氧化剂, 催化剂 |
编号系统
CAS号:7719-09-7
MDL号:MFCD00011449
EINECS号:231-748-8
RTECS号:XM5150000
BRN号:1209273
PubChem号:暂无
物性数据
1.性状:淡黄色至红色、发烟液体,有强烈刺激气味。[11]
2.熔点(℃):-105[12]
3.沸点(℃):76~79[13]
4.相对密度(水=1):1.64[14]
5.相对蒸气密度(空气=1):4.1[15]
6.饱和蒸气压(kPa):13.3(21.4℃)[16]
7.临界压力(MPa):4.43[17]
8.辛醇/水分配系数:0.92[18]
9.溶解性:可混溶于苯、氯仿、四氯化碳等。[19]
10.黏度(mPa·s,0ºC):0.80
11.黏度(mPa·s,38ºC):0.545
12.蒸发热(KJ/mol):31.32
13.生成热(KJ/mol):206.0
14.电导率(S/m):2×10-6
15.蒸气压(kPa,20ºC):13.3
16.蒸气压(kPa,50ºC):42.9
17.蒸气压(kPa,70ºC):85.0
18.蒸气压(kPa,75ºC):99.5
19.体膨胀系数(K-1):0.0010
毒理学数据
1、本品有毒,其蒸气刺激眼睛和黏膜,液体触及皮肤能引起烧伤。
2、毒性比二氧化硫大,蒸气对呼吸道和眼结膜有明显的刺激作用。皮肤接触引起灼伤。工作场所最高容许浓度24.15mg/m3(空气中)。猫吸入85mg/m3浓度的亚硫酰(二)氯蒸气,20分钟可引起死亡。
3.急性毒性[20] LC50:2435mg/m3(大鼠吸入)
生态学数据
对水是稍微危害的,若无政府许可,勿将材料排入周围环境。
分子结构数据
1、摩尔折射率:20.60
2、摩尔体积(cm3/mol):60.8
3、等张比容(90.2K):179.9
4、表面张力(dyne/cm):76.7
5、极化率(10-24cm3):8.17
计算化学数据
1、疏水参数计算参考值(XlogP):1.5
2、氢键供体数量:0
3、氢键受体数量:1
4、可旋转化学键数量:0
5、互变异构体数量:
6、拓扑分子极性表面积(TPSA):17.1
7、重原子数量:4
8、表面电荷:0
9、复杂度:29
10、同位素原子数量:0
11、确定原子立构中心数量:0
12、不确定原子立构中心数量:0
13、确定化学键立构中心数量:0
14、不确定化学键立构中心数量:0
15、共价键单元数量:1
性质与稳定性
1.遇水易分解为二氧化硫和氯化氢。溶于苯、氯仿和四氯化碳中。加热至140℃开始分解生成氯气、二氧化硫和一氯化硫。其氯原子取代羟基或巯基能力显著,有时可以取代二氧化硫、氢或氧。氯化亚砜能与有羟基的酚或醇有机化合物反应生成相应的氯化物,与磺酸反应生成磺酰氯,与格利雅试剂反应生成相应的亚砜化合物。折光能力很强,有如SO2一样令人不愉快的气味。二氯亚砜在稍高于沸点的温度下会发生明显的分解,分解产物为S2Cl2,SO2和Cl2。可溶于苯和三氯甲烷,与水反应生成SO2和HCl。
2.非常活泼,具有强腐蚀性,其蒸气和液体对眼睛、黏膜和皮肤有强烈的刺激作用。操作时应戴防护手套,避免皮肤接触。氯化亚砜须在玻璃瓶内于室温下干燥环境中储存。它与水反应放出有毒气体HCl和SO2,由于SOCl2参与的大部分反应都会放出以上两种气体,所以必须在通风橱中进行操作。SOCl2在高于140 oC时会分解生成Cl2、SO2和S2Cl2,铁和/或锌的杂质会催化加剧该分解反应。
3.稳定性[21] 稳定
4.禁配物[22] 水、碱类
5.避免接触的条件[23] 受热、潮湿空气
6.聚合危害[24] 不聚合
贮存方法
储存注意事项[25] 储存于阴凉、通风的库房。库温不超过30℃,相对湿度不超过75%。保持容器密封。应与碱类等分开存放,切忌混储。储区应备有泄漏应急处理设备和合适的收容材料。
合成方法
1.氯磺酸法 先将硫黄粉加入反应器中,通入氯气进行反应生成一氯化硫。再将一定量的氯磺酸和一氯化硫加入反应器内,在50℃以下通入氯气进行反应,反应好的物料经粗馏、冷凝,收集130℃以下的料液送至精馏锅,为了使低沸点的二氯化硫转变成一氯化硫留在锅内,则要加入粗品数量的15%~20%硫黄,然后送去精馏,经回流4h,色泽正常后,收集气相75~80℃的馏分,制得亚硫酰氯成品。其反应方程式如下:
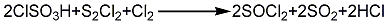
2.二氧化硫法 以硫黄、液氯和液体二氧化硫为原料,采用全循环和液相循环法,生产高纯度氯化亚砜矾,纯度99%以上,该方法工艺先进,产品质量稳定,“三废”排放少。

图XVI-4 制备SOCL2的制备
二氯亚砜也叫亚硫酰二氯或氯化亚硫酰。
图制备SOCl2的装置
1—烧瓶1;2—烧瓶2;3—密封磨口
(1).在如图所示的烧瓶1中加入纯净的发烟硫酸,在烧瓶2中加入SCl2。慢慢加热烧瓶1,并用冰水冷却烧瓶2,SO3进入SCl2中即开始发生反应,放出的SO2通过通风柜排出。当反应完成后将1拆除并密封磨口3,在隔绝湿气的条件下慢慢进行蒸馏。然后在中间馏分中加入硫,仔细地分馏数次。获取76~77℃完全无色的馏分为最后产品。
(2).用一装有回流冷凝管的250mL双口烧瓶作反应器,反应器经彻底干燥后放入100g PCl5。冷凝管的上端联接一支CaCl2干燥管,在反应器的另一口中插入一根导气管至瓶底。从导气管中通入经仔细干燥过的SO2气体,摇荡反应瓶以加速反应进行。数小时后,PCl5全部溶解,反应即完成。用高效能的分馏柱仔细分馏产物数次,可得SOCl2产品。
精制方法:工业品的亚硫酸(二)氯中常含有硫酰氯、一氯化硫和二氯化硫等杂质,一般重蒸一次即可使用,但仍带有黄色。若需高纯度的产品,可将450mL亚硫酰(二)氯与12.5g硫加热回流4.5小时,然后用高效分馏柱分馏两次可得无色纯品。也可在亚磷酸三苯酯存在下进行蒸馏精制。
3.在干燥的五氯化磷中通入干燥的二氧化硫气体,在搅拌下边回流边反应,反应放出的热量将五氯化磷熔融:
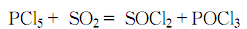
待五氯化磷完全熔融后,加热混合物并搅拌均匀。然后精馏混合物数次,收集77~80℃馏分,即得试剂氯化亚砜。
用途
1.用作有机合成的氯化剂,如醇类羟基的氯化、羧酸的氯化、酸酐的氯化、有机磺酸或硝基化合物的氯置换。制造酰基氯化物。制造医药中间体,例如驱虫净、无味合霉素。还用作脱水剂和溶剂。
2.用作有机合成中的氯化剂和氧化剂,如制备酰基氯,有机酸酐等。也用作催化剂。
3.氯化剂。制氯烷、酰氯,磺酰氯,环状酸酐。由酰胺制腈,甲酰胺制异腈。制氨基酸腈、吡啶4一磺酸。合成杂环,芳亚砜脱氧,等等。
4.氯化亚砜是一种常用的氯代试剂[1,2],其反应性能主要受反应物投料比、溶剂、碱等条件影响。此外它还是常用的脱水试剂,用于催化分子内脱水等消除反应。由于氯化亚砜易分解的性质,它还可以用作电解质溶液,例如:AlCl3/SOCl2的介质溶液[3]。
氯磺酸酯或卤代烃的合成 氯化亚砜能与一级、二级和三级醇反应生成特定的氯磺酸酯(等当量反应)。产物的种类决定于反应条件,尤其是反应物的化学计量数、溶剂和使用的碱。如果2当量的醇在吡啶作用下与氯化亚砜反应,将生成亚硫酸二酯。若亚硫酰氯过量,或氯磺酸酯与氯化亚砜反应,将生成相应的卤代烃,并伴随生成HCl和SO2。因此直接将醇与氯化亚砜在碱作用下反应,是将醇转化为卤代烃的有效的方法之一 (式1)[4]。但是对于不饱和烃α-位取代的醇,由于烯醇式中间体的存在,常发生双键上的氯代反应 (式2)[5]。

酰氯的制备 氯化亚砜还广泛应用于制备酰氯。将羧酸或羧酸酐与SOCl2反应(惰性溶剂或直接以SOCl2为溶剂),可得到相应的酰氯,同时生成HCl和SO2 (式3)[6]。得到的酰氯可继续与氨基反应得到酰胺,该方法通常可以合并为一步反应 (式4)[7]。

芳香醛或α,β-不饱和醛以及它们的亚硫酸盐衍生物可与氯化亚砜反应。例如:丙烯醛、苯甲醛等的羰基可与氯化亚砜发生加成反应,生成相应的二氯代物和SO2。
脱水反应 目前,氯化亚砜最主要的应用还是作为脱水剂使用。特别是在大分子合成领域中,氯化亚砜被广泛应用于分子内关环 (式5)[8] 等一系列反应。
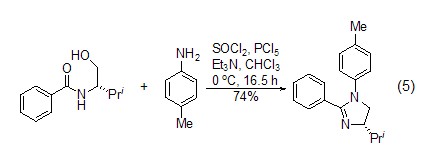
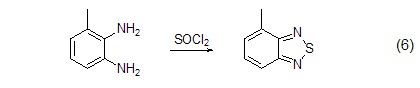
S-N键的生成 可与氨基反应构建S-N键,这一性质常被用于杂原子的成环反应 (式6)[9]。
C-H键的氧化 氯化亚砜还可以氧化比较活泼的C-H键,生成氯代物或亚氯硫代物 (式7)[10],且反应条件通常比较温和。值得注意的是,此类反应往往很容易发生逆反应,还原成原来的C-H键化合物。
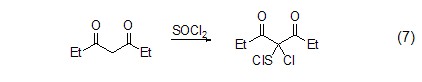
5.用于有机合成,农药及医药工业。[26]
安全信息
危险运输编码:UN 1836 8/PG 1
危险品标志: 腐蚀
腐蚀
安全标识:S26 S45 S36/S37/S39
文献
1. Feng, S.; Panetta, C. A.; Graves, D. E. J. Org. Chem., 2001, 66, 612. 2. Amaresh, R. R.; Lakshmikantham, M. V.; Baldwin, J. W.; Cava, M. P.; Metzger, R. M.; Rogers, R. D. J. Org. Chem., 2002, 67, 2453. 3. Boyle, T. J.; Andrews, N. L.; Alam, T. M.; Tallant, D. R.; Rodriguez, M. A.; Ingersoll, D. Inorg. Chem., 2005, 44, 5934. 4. Amato, J. S.; Chung, J. Y. L.; Cvetovich, R. J.; Gong, X.; McLaughlin, M.; Reamer, R. A. J. Org. Chem., 2005, 70, 1930. 5. Krafft, M. E.; Haxell, T. F. N. J. Am. Chem. Soc., 2005, 127, 10168. 6. Alagic, A.; Koprianiuk, A.; Kluger, R. J. Am. Chem. Soc., 2005, 127, 8036. 7. Mishani, E.; Abourbeh, G.; Jacobson, O.; Dissoki, S.; Daniel, R. B.; Rozen, Y.; Shaul, M.; Levitzki, A. J. Med. Chem., 2005, 48, 5337. 8. Boland, N. A.; Casey, M.; Hynes, S. J.; Matthews, J. W.; Smyth, M. P. J. Org. Chem., 2002, 67, 3919. 9. Jorgensen, M.; Krebs, F. C. J. Org. Chem., 2005, 70, 6004. 10. Hawata, M. A. M.; El-Torgoman, A. M.; El-Kousy, S. M.; Ismail, A. E.-H.; Madsen, J. O.; I. Søtofte, Senning, A. Eur. J. Org. Chem., 2002, 2039. [1~10]参考书:现代有机合成试剂<性质、制备和反应>;胡跃飞 付华 编著;化学工业出版社;ISBN 7-5025-8542-7 [11~26]参考书:危险化学品安全技术全书.第一卷/张海峰主编.—2版.北京;化学工业出版社,2007.6 ISBN 978-7-122-00165-8
备注
暂无




 沪公网安备 31010602001115号
沪公网安备 31010602001115号